Журнал «Педиатрия» №2 2014
Н.А. Иванова1, Г.А. Кузьмина1, Л.Т. Кочиш2, Н.Н. Бегаева2, Н.М. Афанасьева2.
1 Кафедра детских болезней ФГБОУ ВПО Военно-медицинская Академия им. С.М. Кирова Минобороны России, Санкт-Петербург;
2 Лаборатория аллергологии ООО «Вега» группы компаний Алкор Био, Санкт-Петербург.
Вступление
Атопический дерматит является, как правило, самым ранним клиническим проявлением атопии и наиболее часто встречающимся атопическим заболеванием у детей первых лет жизни. Кожные покровы ребенка раннего возраста не случайно становятся "органом-мишенью" аллергической реакции. Это связано с анатомо-гистологическими особенностями, а также с характером иммунного ответа кожи на воздействие антигенов внешней среды у новорожденного и грудного ребенка. Собственно кожа (дерма) и подкожная жировая клетчатка детей первых месяцев жизни представляют собой "средоточие" клеток, участвующих в распознавании, представлении антигенов и в ответе на них. В дерме имеется множество фиброцитов, гистиоцитов, лимфоцитов, плазматических, эндотелиальных клеток. Кожные покровы ребенка в раннем возрасте становятся одним из основных органов, участвующих в формировании атопического типа ответа на антигенное воздействие, и, как следствие, основным "органом-мишенью" аллергических реакций. Исследователи отмечают, что с конца ХХ века появилась тенденция к более ранней манифестации заболевания (с 1-2-го месяца жизни), более тяжелому течению с увеличением площади поражения кожи, более частому, чем в предшествующие десятилетия, формированию респираторной аллергии у детей с АтД.
Педиатры всех без исключения специальностей постоянно сталкиваются с пациентами, у которых имеются клинические проявления аллергического поражения кожи. Безусловно, ребенок с аллергическим заболеванием любой локализации подлежит обследованию и наблюдению у аллерголога, но в реальной жизни, большинство детей длительное время наблюдаются участковыми педиатрами и попадают к специалисту, когда отсутствует результат довольно длительного лечения и дерматит прогрессирует. Подобная ситуация ухудшает прогноз заболевания, поскольку многократно доказано, что максимально рано начатая комплексная терапия наиболее эффективна и в определенной мере может способствовать предотвращению этапного вовлечения в аллергический процесс разных органов и систем т.е. развитию атопического марша. Дети с любым аллергическими заболеваниями нуждаются в постоянном врачебном контроле (мониторировании состояния) для оценки эффективности и коррекции диетотерапии, проведения элиминационных мероприятий дома, оценки эффективности и коррекции фармакологической терапии и т.д. Данный объем наблюдения может осуществить только участковый педиатр.
В представленной работе обобщен многолетний опыт работы с детьми раннего возраста, страдающими АтД, проводимой на кафедре детских болезней ФГБОУ ВПО Военно-медицинская Академия им. С.М. Кирова Минобороны России, Санкт-Петербург (заведующий кафедрой - заслуженный деятель науки, профессор Николай Павлович Шабалов) совместно с лабораторией аллергологии ООО «Вега» группы компаний Алкор Био, Санкт-Петербург (директор Дмитрий Генрихович Полынцев).
Целью работы явился анализ факторов риска развития АтД у детей раннего возраста, изучение спектра сенсибилизации и ответа на различные схемы терапии.
Материалы и методы исследования
В исследование включены 166 детей в возрасте от 1 мес до 3 лет, отвечающих клиническим критериям диагностики АтД, определенным Союзом педиатров России [1].
Формализованная карта анамнеза жизни и заболевания (132 признака) пополнялась оценкой динамики клинических проявлений, иммунологических показателей и эффективности проводимой терапии при повторных визитах. Степень тяжести АтД на момент осмотра и в динамике оценивали по системе SCORAD (SCORing of Atopic Dermatitis) [2]. Клиническая часть исследования проведена на базе клиники детских болезней ФГБОУ ВПО Военно-медицинская Академия им. С.М. Кирова Минобороны России.
Иммунологическое обследование включило в себя следующие исследования.
- Определение общего (Ig) класса E в сыворотке крови проводилось методом твердофазного иммуноферментного анализа (ИФА) - «сэндвич»-вариант - на наборах «ИФА-общий IgE» производства ООО «Компания Алкор Био» (Россия).
- Определение специфических IgE-антител к аллергенам коровьего молока, яйца куриного, пшеницы, клеща домашней пыли и специфических IgG4-антител к перечисленным пищевым аллергенам проводилось методом ИФА (аллергосорбентный тест) в системе ImmunoCAP фирмы Phadia (Швеция).
Положительным считали любой уровень специфических IgE и высокий и очень высокий уровень специфических IgG4-антител. Иммунологические исследования выполнены в лаборатории аллергологии ООО «Диагностические центры «АЛКОР БИО».
Цитоморфологические показатели слизистой оболочки полости носа исследовали методом мазков-отпечатков со слизистой носа, с окрашиванием по Романовскому - Гимзе, с определением клеточного состава по методике Н.С Журавской с соавт. [3] в клинической лаборатории кафедры детских болезней ФГБОУ ВПО Военно-медицинская Академия им. С.М. Кирова Минобороны России.
Для статистической обработки данных использовали методы статистического описания количественных и качественных признаков, графическое представление данных. Оценка значимости различий проведены с помощью параметрического t-критерия Стьюдента.
Результаты и обсуждение.
К группе высокого риска развития аллергических заболеваний относят детей, у которых два ближайших родственника (оба родителя или один из родителей и брат/сестра) имеют атопические заболевания [4], или один родственник имеет атопическое заболевание, а у ребенка повышено содержание IgE в пуповинной крови [5]. Нами проведено изучение семейной отягощенности по аллергическим заболеваниям 166 детей с АтД путем повторных опросов родителей с уточнением клинических проявлений аллергии у родственников 1-й линии родства (мать, отец, старший ребенок) и у родственников 2-й линии родства (бабушки, дедушки, дяди, тети, двоюродные братья и сестры) [6]. По результатам нашего анализа аллергические заболевания у матери и отца встречались с равной частотой (25,2%; n=42). Аллергические заболевания только у старшего ребенка выявлены в 4,9% (n=8) случаев. Наследственная отягощенность у двух родственников 1-й линии родства отмечена в 11,4% (n=19) детей. Наследственная отягощенность по 2-й линии родства выявлена у 14,3% (n=24) пациентов, а отсутствие наследственной отягощенности по аллергическим заболеваниям было у 19,1% (n=32) детей с АтД. Анализ влияния различных вариантов наследственной отягощенности на возраст манифестации АтД показал, что максимально высокая частота (84,2%) ранней (до 3 мес жизни) манифестации заболевания встречалась у детей, имеющих сибсов с аллергическими заболеваниями. Частота ранней манифестации АтД (до 3 мес жизни) в группах пациентов с наследственной отягощенностью по материнской и отцовской линиям составила 78,6% и 64,3% соответственно. Несмотря на то что в целом по группе частота наследственной отягощенности по аллергическим заболеваниям по 2-й линии родства не высока (14,3%), ранняя манифестация АтД у этих пациентов составила 66,6%, что даже несколько выше, чем у детей, отцы которых страдали аллергическими заболеваниями (64,3%). Высокая частота ранней манифестации заболевания (68,7%) выявлена и в группе пациентов, родители которых отрицали аллергические заболевания у родственников. Представленные наблюдения позволяют утверждать, что наличие аллергических заболеваний у отца и матери могут оказывать сравнимое влияние на наследственную предрасположенность к аллергическим заболеваниям у ребенка. Необходимо анализировать семейный анамнез не только по 1-й, но и по 2-й линии родства. Наличие аллергического заболевания у старшего ребенка является наиболее значимым фактором риска. Отсутствие семейной отягощенности по аллергическим заболеваниям не является фактором исключения атопии у ребенка
Своевременная диагностика и раннее терапевтическое вмешательство при аллергическом заболевании кожи во многом определяет успех лечения. Мы сопоставили возраст первых клинических проявлений с возрастом обращения за специализированной медицинской помощью пациентов наблюдаемой нами группы (рисунок 1 и 2).
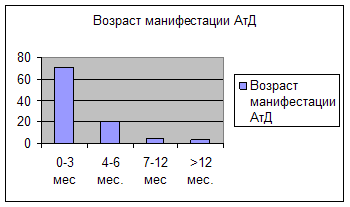 Рисунок 1
Рисунок 1
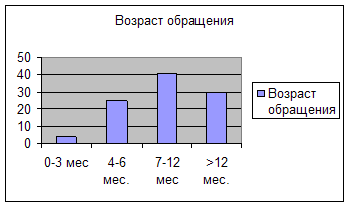 Рисунок 2
Рисунок 2
Как следует из представленных рисунков, манифестация АтД до 3 мес произошла у 71% детей, а обращение за специализированной помощью с назначением адекватной диетотерапии, наружной и системной фарамакотерапии в этом возрасте получили только 4% пациентов. Максимально часто начало комплексной терапии пришлось на возраст от 7 мес, когда у большинства больных имелись длительные и выраженные изменения на коже. До этого возраста дети наблюдались участковыми педиатрами и получали, как правило, неадекватную дието- и фармакотерапию. Данное наблюдение еще раз подчеркивает необходимость повышения уровня знаний участковых педиатров в вопросах диагностики и лечения АтД у детей раннего возраста.
Мы проанализировали диету беременных и кормящих женщин наших пациентов и оценили частоту следующих вариантов питания: сбалансированная физиологическая диета, злоупотребление молочными продуктами (более 1 литра в день молочных продуктов), злоупотребление облигатными аллергенами (шоколад, цитрусовые, клубника, ежедневное употребления в пищу куриных яиц) и консервированными продуктами.
По результатам нашего исследования 57% беременных женщин соблюдали нормальную сбалансированную диету с ограничением в питании облигатных аллергенов и консервированных продуктов, употреблением 400-500 мл молочных продуктов в день; 10% беременных не ограничивали употребление облигатных аллергенов, а 33% беременных женщин употребляли молочные продукты в количестве более 1 литра в день (молоко, кисломолочные продукты, творог 200 г и более).
Во время вскармливания грудью процентное соотношение диет несколько изменилось. Уменьшился процент матерей, употребляющих в пищу облигатные аллергены, - с 10 до 3%, но значимо увеличился процент кормящих, злоупотребляющих молочными продуктами, - с 33% до 55%. Такая «традиция питания» беременных и кормящих связана, вероятно, с опасениями дефицита кальция у матери и распространенным мнением о необходимости употребления большого количества молочных продуктов для поддержания лактации, а беременные женщины, да и многие педиатры, не рассматривают этот продукт питания как облигатный аллерген. Перегрузка пищевого рациона кормящих женщин молочными продуктами относится к факторам риска развития АтД, и в настоящее время аллергены коровьего молока рассматриваются как наиболее значимые в развитии сенсибилизации у детей раннего возраста [7]. В согласительном документе по первичной профилактике аллергии у детей 2010 г. сказано, что нет документированных свидетельств необходимости соблюдения во время беременности и грудного вскармливания какого-либо типа ограничивающих и элиминационных диет [8]. В то же время многочисленные исследования отечественных и зарубежных авторов доказывают, что антигены коровьего молока, куриного яйца, глиадина, белки арахиса могут обнаруживаться (в течение 1-6 ч после потребления пищевых продуктов) в женском молоке не зависимо от наличия у матерей аллергических заболеваний. Количество указанных аллергенов в грудном молоке достаточно для индукции сенсибилизации и развития ранних клинических проявлений пищевой аллергии [9, 10].
Докорм молочной смесью в родильном доме из 166 детей с АтД получили 103 (62%) ребенка. Всем детям была дана молочная смесь на основе цельных, негидролизованных белков коровьего молока. Манифестация АтД до 3 мес жизни произошла у 77 (74,5%) из 103 детей, получивших докорм, и у 16 (25,3%) из 63 детей, не получивших докорм молочной смесью в родильном доме (p<0,05). Таким образом, докорм молочной смесью на основе цельных белков коровьего молока является достоверным фактором риска ранней манифестации АтД у детей из группы риска по развитию аллергических заболеваний.
АтД – аллергическое заболевание кожи, возникающее, как правило, в раннем детском возрасте у лиц с наследственной предрасположенност к атопическим заболеваниям, имеющее хроническое рецидивирующее течение, возрастные особенности локализации и морфологии очагов воспаления, характеризующееся кожным зудом и обусловленное гиперчувствительностью как к аллергенам, так и к неспецифическим раздражителям [11]. Термин «атопический» указывает на то, что ведущим патогенетическим механизмом является IgE-опосредованная иммунопатологическая реакция. Однако результаты многочисленных отечественных и зарубежных исследований указывают на то, что только у 40-50% детей раннего возраста с клиническими проявлениями аллергического поражения кожи удается подтвердить IgE-зависимую форму заболевания [12, 13]. Всемирная организация аллергологов в октябре 2003г. пересмотрела классификацию АтД, которая была представлена на Европейской академии аллергологии и клинической иммунологии в 2004 г.
Экспертами был предложен термин «синдром атопической экземы/дерматита» (atopic eczema/dermatitis syndrome, AEDS) и принята следующая классификация этого синдрома (рисунок 3).
СИНДРОМ АТОПИЧЕСКОЙ ЭКЗЕМЫ/ДЕРМАТИТА (AEDS)
АЛЛЕРГИЧЕСКИЙ НЕАЛЛЕРГИЧЕСКИЙ
IgE- не-IgE
опосредованный опосредованный Рисунок 3
Данный пересмотр AEDS позволил Союзу педиатров России определить АтД (атопическую экзему, синдром атопической экземы/дерматита) как хроническое воспалительное заболевание кожи, сопровождающееся зудом, возрастной морфологией высыпаний и стадийностью [1].
Повторные определения специфических IgE- и IgG4-антител в сыворотке крове явились основанием для разделения 166 обследованных пациентов на 3 группы (см. таблицу).
В 1-ю группу вошли 93 (56%) пациента с доказанной IgE-зависимой формой АтД. У этих детей при повторных иммунологических исследованиях выявлены IgE-антитела к тем или иным исследуемым аллергенам и почти у 50% пациентов - как IgE-, так и IgG4-антитела.
Вторую группу составили 35 (21%) детей с клиническими проявлениями синдрома AEDS, у которых отсутствовали специфические IgE-антитела к исследуемым аллергенам, но определялся высокий и очень высокий уровень специфические IgG4-антител.
К 3-й группе отнесены 38 (22,9%) детей с клиническими кожными проявлениями, у которых при повторных иммунологических исследованиях не удалось выявить специфических IgE- и IgG4-антител.
Таблица
Распределение пациентов по группам в зависимости от результатов определения специфических IgE- и IgG4 – антител в сыворотке крови
|
Количество пациентов |
ГРУППА |
ВСЕГО |
||
|
1-я группа
IgE «+» |
2-я группа IgE «-» IgG4 «+»
|
III группа IgE «-» IgG4 «-»
|
||
|
Абс. |
93 |
35 |
38 |
166 |
|
% |
56,0 |
21,1 |
22,9 |
100 |
В соответствии с приведенной выше классификацией синдрома атопической экземы/дерматита (AEDS) можно считать, что 1-я группа обследованных детей относится к аллергической IgE-зависимой форме заболевания; пациентов 2-й группы можно отнести к аллергической не IgE-зависимой форме, а пациентов 3-й группы – к неаллергической форме заболевания.
Тяжесть течения АтД на момент включения в исследование оценена по системе SCORAD [2]. Состояние как среднетяжелое и тяжелое было расценено у 36,6% детей с IgE-зависимой формой заболевания, у 8,75% (p<0,05) детей с аллергической не- IgE-зависимой формой и у 31,6% детей, у которых доступными нам методами сенсибилизацию выявить не удалось.
У детей с IgE-зависимой формой заболевания сенсибилизация к белкам коровьего молока выявлена в 59,1% случаев, к аллергену куриного яйца – в 57,0%, аллергену пшеницы – в 26,9% и к аллергену клеща домашней пыли - в 34,4% случаев. Специфические IgG4-антитела к молоку присутствовали у 56,3% детей с IgE-антителами к молоку; специфические IgG4-антитела к аллергену куриного яйца имели 56,6% детей с IgE-сенсибилизацией к яйцу; у 37,5% пациентов с выявленной IgE-сенсибилизацией к аллергену пшеничной муки имелись специфические IgG4-антитела к этому аллергену. Таким образом, не все пациенты с выявленной IgE-сенсибилизацией к пищевым аллергенам имели соответствующие IgG4-антитела, которым отводится протективная роль в развитии клинических проявлений пищевой аллергии [14].
IgE-антитела к куриному яйцу выявлены у 10 детей первого полугодия жизни, которые этот пищевой продукт никогда не получали. Данное наблюдение подтверждает возможность сенсибилизации к пищевым аллергенам через грудное молоко и, возможно, от матери во время беременности. Следует обратить внимание на высокую частоту сенсибилизации к аллергену пшеницы, что необходимо учитывать при составлении элиминационной диеты матери и при введении прикормов. Клинические проявления АтД при сенсибилизации к пшенице отличаются тяжелыми проявлениями и медленным ответом на элимнационную диету.
У 32 детей с IgE-зависимой формой АтД при первом иммунологическом исследовании подтверждена сенсибилизация к аллергену клещей домашней пыли. Аллергические заболевания респираторного тракта за время диспансерного наблюдения (длительностью до 7 лет) диагностированы у 36 (38,7%) детей с IgE- зависимой формой АтД. У 18 (19,3%) детей сформировалась атопическая бронхиальная астма (БА) и у 18 (19,3%) - аллергический ринит (АР).
АтД является стартовой нозологической формой в развитии атопической болезни, т.е. является доказанным фактором риска развития АР. Дифференциальная диагностика аллергического и инфекционного ринита у детей раннего возраста представляет определенные трудности, кроме того, принято считать, что проявления респираторной аллергии характерны для детей 5-6-летнего возраста. Нами проведено цитоморфологическое исследование мазков-перепечатков со слизистой оболочки полости носа 46 детям с АтД в возрасте от 3 мес до 3 лет. У 36 (78,2%) детей в мазках выявлены эозинофилы. 9 детей с выявленными эозинофилами в риноцитограмме на момент исследования не имели клинического диагноза респираторной аллергии, и родители не предъявляли активных жалоб со стороны дыхательной системы у ребенка. Учитывая высокую частоту формирования респираторной аллергии у детей с IgE-зависимой формой АтД, данные результаты, вероятно, можно расценивать как доклинические признаки вовлечения в аллергическое воспаление слизистой оболочки полости носа. Следует подчеркнуть, что 7 из 9 пациентов с выявленными эозинофилами в риноцитограмме были 1-го года жизни. Безусловно, наличие эозинофилов в риноцитограмме без клинических проявлений не является основанием для установления диагноза АР, но является подтверждением системности аллергического воспаления, необходимости обратить внимание родителей на возможно имеющиеся проявления АР. Как было показано в исследовании, посвященном диагностике АР у больных БА [15], родители на фоне более беспокоящих симптомов не обращали внимания на первые клинические проявления АР у ребенка. Кроме того, наличие морфологических признаков системности аллергического воспаления указывают на целесообразность использования в терапии системных противоаллергических препаратов (антигистаминные препараты, кетотифен, монтелукаст).
При наличии подтвержденной IgE-сенсибилизации уровень общего IgE в сыворотке крови целом по группе был выше, чем у пациентов с не IgE-зависимой формой заболевания, но только у 48,3% детей был выше возрастной нормы. Полученный результат согласуется с данными литературы [14] и указывает на то, что определение только уровня общего IgE для подтверждения атопической природы заболевания является недостаточно информативным.
У 35 детей с аллергической не-IgE-зависимой формой дерматита выявлен высокий и очень высокий уровень специфических IgG4–антител к коровьему молоку (85,75%), куриному яйцу (28,6%) и пшенице (11,4%). Для пациентов этой группы характерна более поздняя манифестация кожных проявлений и более легкое течение заболевания по сравнению с детьми раннего возраста, страдающими IgE-зависимой формой АтД. Кормящие матери детей как с IgE-зависимой, так и с не-IgE-зависимой формами AEDS до включения в исследование не ограничивали в рационе количество молочных продуктов, однако у 51,5% детей с выявленными IgG4–антителами к коровьему молоку манифестация дерматита произошла только после введения молочного прикорма, т.е. после увеличения нагрузки белком коровьего молока (дозозависимый эффект). В процессе динамического наблюдения также отмечена отчетливая зависимость от дозы пищевого продукта, к которому обнаружены IgG4–антитела.
Наличие IgG4-антител само по себе не является диагностическим признаком сенсибилизации к пищевому продукту. Однако пациенты этой группы имели наследственную отягощенность по аллергическим заболеваниям, сравнимую с пациентами с IgE-зависимой формой АтД, и клинические проявления, соответствующие критериям диагностики аллергического поражения кожи. В исследовании 2012 г. Komei Itol и соавт. [13] проведено определение IgE- и IgG4-специфических антител к белкам коровьего молока, сравнение реакции на пищевой провокационный тест детям с анамнезом клинической реакции на употребление коровьего молока. На основании результатов проведенной работы высказано предположение и согласие с другими исследователями [16], что IgG4-антитела можно отнести к регуляторам измененного у атопиков Th2-пути иммунного ответа, и они обладают профилактической (протективной) ролью в развитии молочной аллергии путем блокирования презентации антиген-специфичных Т-клеток. Возможно, это подтверждается и имеющейся у пациентов этой группы зависимостью клинических проявлений от дозы пищевого продукта и тем, что у 5 (14,3%) пациентов, которые при включении в исследование были отнесены к аллергической не-IgE-зависимой форме AEDS, при проведении аллергологического обследования в динамике диспансерного наблюдения была подтверждена IgE-сенсибилизация.
В проведенном нами исследовании и в исследованиях других авторов [16] представлены группы пациентов с клиническими проявлениями АтД, у которых не выявлялись ни IgE-антитела, ни IgG4-антитела в диагностическом уровне при повторных иммунологических исследованиях. У детей данной группы не произошло нарастания исходно низкого уровня общего IgE (28,97±7,85 МЕ/мл при первом исследовании и 27,32±6,87 МЕ/мл при исследовании через 6-12 мес), хотя у 22 (57,8%) пациентов заболевание имело среднетяжелое/тяжелое течение, сходное по клиническим проявлениям с детьми с IgE-зависимой формой АтД. Исходя из полученных результатов, нельзя исключить, что в эту группу попали пациенты с неустановленным нами иммунопатологическим механизмом формирования заболевания [17]. Ни у одного пациента не диагностирована БА, у 2 детей имеются клинические проявления аллергического ринита, подтвержденного при исследовании риноцитограммы, но спектр сенсибилизации не подтвержден.
16 детей этой группы с легким течением заболевания, у которых в процессе динамического наблюдения не выявлена ни IgE-, ни IgG4 –сенсибилизация, можно отнести к неаллергической форме AEDS. Подобное состояние описано как «eczema infantum», преходящее поражение кожных покровов [18].
Учитывая полученную в нашем исследовании гетерогенность клинико-иммунологических форм АтД, был проведен анализ эффективности комплексной терапии, необходимой для достижения клинической ремиссии заболевания.
Схема 1 терапии включала: диетотерапию, уход за кожей, пимекролимус, длительные курсы антигистаминных препаратов.
Схема 2 терапии включала: диетотерапию, уход за кожей, короткие курсы антигистаминных препаратов.
Рисунок 4
Частота использования схем терапии по группам

р< 0.05 р<0.05
Как следует из представленных результатов, схема 1 терапии достоверно чаще была необходима и эффективна у детей с IgE-зависимой формой АтД (66%, n=55). Только 8 (22,8%) пациентам с аллергической не-IgE-зависимой формой заболевания исходно была назначена схема 1лечения в соответствии с выраженностью клинических проявлений дерматита. Длительность применения данной схемы лечения до достижения клинической ремиссии заболевания для пациентов 2-й группы была существенно меньше, чем у пациентов с IgE-зависимой формой АтД. Кроме того, мы отметили практически отсутствие эффекта от пимекролимуса у детей с отсутствием IgE-сенсибилизации и наличием IgG4-антител к пищевым аллергенам.
Достоверные различия в частоте использования схемы 1 лечения получены и при сравнении 2-й (22,8%, n=8) и 3-й (57,9%, n=22) групп. В 3-й группе в назначении схемы 1 лечения нуждались дети с упорно рецидивирующим течением заболевания, у которых мы предполагаем не выявленный в нашем исследовании иммунопатологический механизм развития заболевания. Эти пациенты хорошо отвечали на терапию пимекролимусом, обладающим топическими иммуносупрессивными свойствами, что также может служить косвенным подтверждением наличия иммунопатологического процесса в коже у пациентов данной группы. Данное наблюдение является, на наш взгляд, подтверждением необходимости использования в клинической практике patch-теста с пищевыми аллергенами, что повысит частоту выявления причинно-значимых пищевых аллергенов. К сожалению, в настоящее время этот метод аллергодиагностики практически недоступен.
При грудном вскармливании диетотерапию начинали с анализа диеты кормящей матери. При IgE-зависимой форме АтД из диеты матери полностью исключали причинно-значимый аллерген и ограничивали продукты с высокими аллергизирующими свойствами. Проводилась коррекция питания матери в соответствии с элиминацией. При достижении полной и длительной клинической ремиссии АтД и отрицательных результатах повторного аллергологического обследования, что указывало на формирование толерантности к белкам коровьего молока, проводилось постепенное введение в диету кормящей матери молочных продуктов под контролем клинических проявлений. Как правило, расширение диеты матери удавалось проводить к концу 1-го года жизни ребенка. При сенсибилизации к куриному яйцу этот продукт в питание матери не вводился до окончания грудного вскармливания.
При аллергической не-IgE-зависимой форме дерматита и выявленном высоком уровне IgG4-антител к аллергенам коровьего молока молочные продукты в диете матери исключались или ограничивались, что зависело от выраженности клинических проявлений у ребенка. В этой группе пациентов расширение диеты матери удавалось проводить в более ранние сроки, но с обязательным учетом дозозависимости, характерной для детей этой группы, т.е. количественного ограничения употребляемых продуктов.
Рекомендации по коррекции и длительности соблюдения диеты матерям детей с неподтвержденной IgE-сенсибилизацией и отсутствием IgG4-антител, но с выраженными проявлениями дерматита соответствовали рекомендациям пациентам с IgE-зависимой формой заболевания.
При искусственном вскармливании при любой форме заболевания всем детям с клиническими проявлениями кожного аллергического процесса в качестве стартовой диетотерапии назначаются смеси на основе глубокого гидролиза белков коровьего молока или (по показаниям) смеси на основе аминокислот.
При IgE-зависимой форме и у детей без выявленной сенсибилизации, но со схожими клиническими появлениями (22 ребенка 3-й группы), смеси на основе глубокого гидролиза белков коровьего молока использовались до конца 1-го года жизни. Мы считаем, что попытки замены смесей на основе глубокого гидролиза белков коровьего молока на смеси на основе козьего молока следует проводить с осторожностью или не проводить совсем. Ранее нами было показано, что у 57% детей с сенсибилизацией к белкам коровьего молока имеется сенсибилизация и к белкам козьего молока [13]. Далее расширение диеты проводилось под контролем иммунологических исследований, но при условии длительной ремиссии кожного процесса. Рыбу, мясо курицы до 1 года в рацион питания не вводили. В качестве мясного прикорма использовали мясо индейки и свинины. Куриное яйцо исключали до 3 лет жизни.
При искусственном вскармливании детей с аллергической не-IgE-зависимой формой заболевания и легкими клиническими проявлениями при достижении стойкой клинической ремиссии был возможен переход на гипоаллергенные смеси (частичный гидролиз белков коровьего молока) или на смесь на основе козьего молока на 1-м году жизни. Следует отметить, что у детей с выявленным высоким и очень высоким уровнем специфических IgG4-антител, т.е. с аллергической не-IgE-зависимой формой дерматита, остается дозозависимость в возрасте старше 3 лет: высокая нагрузка сгущенным молоком, какао, творогом, яйцами в детском саду приводит к возобновлению клинических проявлений заболевания после достигнутой пищевой толерантности и длительной ремиссии заболевания. Поскольку пациенты данной группы потенциально угрожаемы по формированию IgE-зависимой формы АтД, целесообразно проводить им аллергологическое обследование в динамике.
Заключение
Диагностика и комплексная терапия АтД у детей раннего возраста является неотъемлемой частью повседневной работы участковых педиатров. Прежде всего, необходимо проводить профилактику манифестации АтД у ребенка, разъясняя женщинам из группы риска необходимость соблюдения ограничительных сбалансированных диет во время беременности и вскармливания грудью. В случае появления абсолютных показаний к докорму в родильном доме - рекомендовать использовать смеси на основе частичного гидролиза белков коровьего молока.
Правильно собранный семейный анамнез, своевременное аллергологическое обследование, знание основ диетотерапии, наружной и системной терапии АтД позволит начинать адекватное лечение при первых клинических признаках аллергического поражения кожи. Существует ошибочное мнение о неинформативности аллергологического обследования in vitro у детей 1-го года жизни. Как показал наш опыт, аллергообследование у детей раннего возраста не только информативно, но и позволяет выделить различные клинико-иммунологические формы заболевания, которые имеют особенности течения, ответа на диетотерапию и прогноз заболевания.
Литература
- Аллергия у детей: от теории к практике под редакцией Л.С. Намазовой-Барановой.- Москва, Союз педиатров России, 2010-2011.
- Severity scoring of atopic dermatitis: the SCORAD index (Consensus report of the European Task Force on atopic dermatitis // Dermatology. – 1993. – Vol. 186. – P. 23-31.
- Журавская Н.С., Виткина Т.И., Круковская Е.А. и др. Метод мазков-отпечатков со слизистой носа в диагностике заболеваний органов дыхания // Клин. лабораторная диагностика. - 2002. - № 2. - С. 40-42.
- Bohm V. Et al.// Fllergy. – 2003. – Vol. 33. – P. 1226-1231.
- Bousquet J., Merando J.L., Robinet-Levy M. Michel F.B. Moglichkeiten der Vorhersage allergischer Erkrankungen im Sauglingsalter/ In: Aktuelle Probleme der pad. Allergologie. Wahn (ed). Stuttgart: Gustav Fischer. 1983, p. 43-54.
- Афанасьева Н.М., Иванова Н.А., Кузьмина Г.А., Кочиш Л.Т. Роль наследственного фактора в развитии атопического дерматита.//Российский аллергологический журнал.- 2013. №2.-С. 21-22.
- Ushiyama Y., Matsumoto K., Shinohara M., et al. Nutrition during pregnancy may be associated with allergic diseases in infants. //J Nutr Sci Vitaminol 2002: 48 (5): 345-51.
- Согласительный документ ассоциации детских аллергологов и иммунологов. Первичная профилактика аллергии у детей. Москва. 2010.- С.72.
- Боровик Е.Э. Грудное вскармливание и пищевая аллергия у детей. //Выступление на конгрессе педиатров, Москва, 26 февраля 2012 г.
- Турти Т.В., Намазова-Баранова Л.С., Яцик ГВ., Зимина Е.П. Роль пищевой гиперчувствительности в раннем формировании атопического статуса у новорожденных детей.//Вопр. соврем. Педиатрии.-2011. - №10(4).- С. 10- 15.
- Аллергология. Клинические рекомендации. Под ред. Р.М. Хаитова, Н.И. Ильиной. М., 2009.
- Host A., Andrae S., Charkin S., et al. Allergy testing in children: why, who, when and how? // Allergy. – 2003; 58:- С. 559-569.
- Н.А. Иванова, Г.А. Кузьмина, Л.Т. Кочиш, Н.Н. Бегаева, Н.М. Афанасьева. Клинико-иммунологическая характеристика детей раннего возраста с атопическим дерматитом.//Российский аллергологический журнал.– 2011.- №5.- С. 31-36.
- Itol K., Futamural M., Moverare R. et al. The usefulness of casein-specific IgE and IgG4 antibodies in cow’s milk allergic children//Clinical molecular Allergy.- 2012; 10:1.
- Masuda S., Fujisawa T., Katsumata H., Atsuta J, Iguchi K. High prevalence and young onset of allergic rhinitis in children with bronchial asthma.//Pediatr Allergy Immunol 2008.
- van Neerven RJ., Knol EF., Ejrnaes A., Wurtzen PA. IgE-mediated allergen presentation and blocking antibodies: regulation of T-cell activation in allergy.//Int Arch Allergy Immunol 2006,- V.141. - P.119-129.
- Neggemann B., Ziegert M., Reibel S. еt al. Importance of chamber size for the outcome of atopy patch testing in children with atopic dermatit and food allergy.// J.Allergy Clin. Immunol. 2002,- V.110.- P. 515-516.
- Folster-Holst R., Pape M., Buss Y. et al. Low prevalence of intrinsic form of atopic dermatitis among adult patient. //Allergy. 2006. - V. 61. - P. 620- 632.