Статья опубликована: Справочник заведующего КДЛ №9, сентябрь 2021, страницы 46-56
Гавриш В.С.1, Шаркова В.Е.1, Полынцев Д.Г.1, Оленькова О.М. 2, Бейкин Я.Б. 2, Старокорова Е.Ю. 2, Нечаева В.В. 2, Зыкова Т.М. 2, Ламонова Н.Ю.2
1 – ГК Алкор Био
2 – ГАУЗ СО «Клинико-диагностический центр г. Екатеринбург»
Резюме
Выявление антител IgG в поствакцинальный период вызывает множество вопросов, связанных с различиями в результатах, получаемых с использованием разных коммерческих тест-систем для иммуноферментного анализа. Целью настоящего исследования было определение практической ценности использования коммерческих тест-систем при оценке формирования протективного иммунитета против новой коронавирусной инфекции после вакцинации препаратом «Гам-КОВИД-вак» (Спутник V) в сравнении с методом реакции микронейтрализации вируса. Показано, что информативность определения наличия антител IgG после вакцинации в первую очередь зависит состава антигенов-мишеней в лунках иммунобиологического планшета конкретной тест-системы.
Ключевые слова: COVID-19, SARS-CoV-2, IgG, нейтрализующие антитела, иммуноферментный анализ, реакция микронейтрализации вируса, «Гам-КОВИД-вак»
Введение:
В конце 2019 г. в Китайской Народной Республике (КНР) произошла вспышка новой коронавирусной инфекции с эпицентром в городе Ухань (провинция Хубэй). Всемирная организация здравоохранения (ВОЗ) определила официальное название инфекции, вызванной новым коронавирусом, – COVID-19 («Coronavirus disease 2019»), Международный комитет по таксономии вирусов присвоил официальное название возбудителю инфекции – SARS-CoV-2. 11 марта 2020 г. ВОЗ объявила о начале пандемии COVID-19. В условиях продолжающейся пандемии COVID-19 остро стоит вопрос о защите населения от вируса SARS-CoV-2 путем вакцинации. На данный момент в Российской Федерации зарегистрированы 5 вакцин: «Гам-КОВИД-Вак», «Гам-КОВИД-Вак-Лио», «ЭпиВакКорона», «КовиВак», «Спутник Лайт» [1].
Согласно постановлению Правительства Российской Федерации от 31 января 2020 г. № 66, новая коронавирусная инфекция, вызванная SARS-CoV-2, включена в перечень заболеваний, представляющих опасность для окружающих. Для специфической профилактики COVID-19 с 18.01.2021 г. в Российской Федерации проводится массовая вакцинация населения [1]. Согласно Временным методическим рекомендациям Минздрава по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19), выявление антител к SARS-CoV-2 имеет вспомогательное значение для диагностики текущей инфекции и основное – для оценки иммунного ответа на текущую или перенесенную инфекцию, а также используется для оценки поствакцинального иммунитета [1].
В связи с этим, возросла потребность в определении наличия антител IgG, в том числе вируснейтрализующих, в поствакцинальный период. Однако, получаемые методом ИФА или ИХЛА результаты сами по себе вызывают множество вопросов, как по наличию или отсутствию антител, так и по степени полезности имеющихся у пациента антител.
Инфицирование коронавирусами стимулирует образование антител против эпитопов, расположенных на структурных белках: S (Spike или шиповидный белок), M (мембранный белок), N (нуклеокапсидный белок), Е (Envelope или оболочечный белок), и HE (поверхностный гликопротеин). Белки S и N являются наиболее иммуногенными из структурных вирусных белков и, гуморальный ответ формируется в основном на эти белки. Возникает следующий вопрос, в пробе пациента обнаружено высокое содержание антител, но их состав не известен. Антитела могут быть связывающими и нейтрализующими, но только нейтрализующие антитела активно препятствуют проникновению вируса в клетку. Основные эпитопы для нейтрализующих антител содержит белок S, функционирующий в виде тримера. Каждый его мономер состоит из 2-х субъединиц – S1 и S2. На субъединице S1 выделяют участок RBD, ответственный за связывание с рецептором ACE2, расположенным на мембранах клеток и являющимся точкой входа в клетку для некоторых коронавирусов [2, 3, 4, 5]. Соответственно, нейтрализующие антитела к этому участку белка S должны обладать протективным действием.
Все коммерческие тест-системы для иммуноферментного (и иммунохемилюминесцентного) анализа, предназначенные для определения антител IgG к SARS-CoV-2 в сыворотке крови человека, построены на едином принципе: рекомбинантные белки SARS-CoV-2 иммобилизованы на твердой фазе (внутренняя поверхность лунок иммунобиологического планшета). Если в образце присутствуют специфические иммуноглобулины G к SARS-CoV-2, то во время первой инкубации происходит их связывание с антигенами твердой фазы, а во время второй инкубации с антителами к иммуноглобулинам G человека, конъюгированными с пероксидазой хрена. Во время инкубации с раствором ТМБ происходит окрашивание раствора в лунках. Степень окраски прямо пропорциональна количеству иммуноглобулинов G в исследуемых пробах.
Значимые различия в конструкции разных тест-систем обусловлены только выбором антигенов-мишеней, иммобилизованных на твердой фазе. Это могут быть отдельные белки – N или S (полноразмерный или его отдельные фрагменты) или же их сочетание (Таблица 1). В связи с этим данные, получаемые в наборах разных производителей, могут различаться между собой как по статусу образца сыворотки крови (положительный или отрицательный), так и по коэффициенту позитивности (КП), при этом, чем выше КП, тем большее количество антител IgG содержится в исследуемом образце.
Таблица 1
Пример использования антигенов на твердой фазе в ИФА-наборах разных производителей
|
Название тест-системы |
Производитель |
Используемые антигены-мишени |
|
|
«SARS-CoV-2ИФА-IgG» |
ООО «Компания Алкор Био» (Россия) |
Белок N+ RBD (фрагмент субъединицы S1) |
|
|
«ДС-ИФА-АНТИ-SARS-CoV-2-G» |
НПО «Диагностические системы» (Россия) |
Белок N + белок S |
|
|
«SARS-CoV-2-IgG-ИФА-БЕСТ» |
АО «Вектор-Бест» (Россия) |
Белок S |
|
|
«Anti-SARS-CoV-2 ELISA (IgG)» |
EUROIMMUN (Германия) |
Субъединица S1 |
|
Уровень антител, которые способны нейтрализовать вирус SARS-CoV-2, может определяться с помощью реакции микронейтрализации вируса (РМН) [6, 7, 8]. Результат выражается в титрах, чем выше уровень нейтрализующих антител и их титр, тем в большее число раз может быть разведен образец сыворотки с сохранением способности антител противостоять цитопатическому действию вируса [9]. Однако, данный метод не доступен для массовых исследований в виду того, что требует наличия высококвалифицированного персонала и условий для культивирования вируса, соответствующих третьему уровню биологической безопасности, сложен и длителен в исполнении.
Цель исследования: сравнить результаты определения антител IgG в поствакцинальный период методами ИФА с использованием разных коммерческих тест-систем и «золотым стандартом» для любого серо-эпидемиологического теста, разрабатываемого или уже разработанного, – методом реакции микронейтрализации вируса (РМН); оценить способность того или иного теста определять уровень поствакцинального протективного иммунитета в конкретный промежуток времени, спровоцированного вакциной «Гам-КОВИД-вак».
Материалы и методы
В рамках заявленного исследования специалистами ГАУЗ СО «Клинико-диагностический центр г. Екатеринбург» были проанализированы образцы 93-х пациентов (20 мужчин и 73 женщины) от 21 до 64 лет. Все пациенты были вакцинированы препаратом «Гам-КОВИД-вак» (Спутник V), разработанным ФГБУ «НИЦЭМ им. Н. Ф. Гамалеи» Минздрава России [10]. Данная выборка образцов сыворотки крови была «слепой»: история пациента не была известна; отсутствовали сведения о периоде времени между введением 1-й дозы вакцины и датой забора крови, прошел ли пациент полный курс вакцинации, не были доступны сведения о том, перенес ли вакцинированный COVID-19 перед вакцинацией. Наличие или отсутствие иммуноглобулинов IgG в сыворотке крови оценивали методом ИФА с применением коммерческих тест-систем, использующих разные варианты антигенов в составе твердой фазы, описанные в Таблице 1. Анализ проводили в соответствии с инструкциями производителей.
Для выяснения причин разницы в результатах при оценке напряженности поствакцинального иммунитета, полученных с помощью коммерческих тест-систем методом ИФА, было проведено исследование образцов сыворотки крови, забранных на разных сроках после вакцинации препаратом «Гам-КОВИД-вак» у добровольцев (Спутник V): перед вакцинацией (точка 0), через 21 день (точка 1), через 42 дня (точка 2) и через 70 дней (точка 3) после введения 1-й дозы вакцины. В исследовании принимали участие 53 добровольца (28 мужчин и 25 женщин) от 21 до 88 лет. Все образцы сыворотки крови были проанализированы методом ИФА с использованием коммерческих тест-систем со следующим составом антигенов на твердой фазе: белок N + фрагмент RBD белка S (набор «SARS-CoV-2ИФА-IgG», ООО «Компания Алкор Био» (Россия)) и белок S (набор «SARS-CoV-2-IgG-ИФА-БЕСТ», АО «Вектор-Бест» (Россия)). Анализ проводили в соответствии с инструкциями производителей. Параллельно на каждом сроке забора крови была проведена РМН по стандартной процедуре: в лунках планшета готовили последовательные разведения исследуемых образцов сыворотки крови от 1/10 до 1/1280, для каждого образца. Затем по стандартной методике к каждому разведению сыворотки крови добавляли рабочее разведение вируса SARS-CoV-2 и после инкубации смесь вносили в планшет с клетками Vero. Через 4 дня результаты РМН учитывались визуально по наличию или отсутствию характерного вирусного цитопатического действия.
Результаты и обсуждение
Были проанализированы образцы 93-х пациентов, вакцинированных «Гам-КОВИД-вак» (Спутник V). У 79-и пациентов были обнаружены IgG против вируса, у двух пациентов антитела отсутствовали, у 12-и пациентов было получено расхождение результатов, как по величине коэффициента позитивности (КП), так и по статусу между разными тест-системами (Таблица 2). В таблице приведены только противоречащие друг другу результаты.
Таблица 2
Коэффициенты позитивности и статус (отрицательный/положительный) по антителам IgG в одном и том же образце, измеренные разными коммерческими тест-системами
|
№ образца |
пол |
возраст |
Антигены-мишени |
|||
|
N+RBD |
N+S |
S |
S1 |
|||
|
Компания Алкор Био |
Диагностические системы |
Вектор-Бест |
EUROIMMUN |
|||
|
5 |
ж |
50 |
0,5 (отр.) |
- |
16,8 (пол.) |
4,3 (пол.) |
|
7 |
ж |
36 |
0,5 (отр.) |
- |
5,1 (пол.) |
2,0 (пол.) |
|
10 |
ж |
52 |
1,1 (пол.) |
- |
14,7 (пол.) |
2,2 (пол.) |
|
12 |
м |
37 |
0,8 (отр.) |
- |
8,7 (пол.) |
2,0 (пол.) |
|
17 |
м |
45 |
0,9 (отр.) |
- |
12,3 (пол.) |
2,1 (пол.) |
|
29 |
ж |
55 |
8,9 (пол.) |
- |
17,2 (пол.) |
0,1 (отр.) |
|
30 |
ж |
56 |
0,7 (отр.) |
- |
10,6 (пол.) |
1,8 (пол.) |
|
53 |
ж |
45 |
0,4 (отр.) |
4,2 (пол.) |
- |
1,2 (пол.) |
|
65 |
ж |
25 |
0,8 (отр.) |
12,6 (пол.) |
- |
2,3 (пол.) |
|
69 |
ж |
43 |
0,8 (отр.) |
13,2 (пол.) |
- |
2,2 (пол.) |
|
89 |
м |
47 |
1,6 (пол.) |
0,9 (отр.) |
- |
0,4 (отр.) |
|
90 |
м |
40 |
0,9 (отр.) |
6,8 (пол.) |
- |
2,1 (пол.) |
Если КП выше 1,1 (точка отсечки ИФА, объяснение см. в подписи к рис. 2), результат рассматривается как положительный, то есть наличие антител подтверждено, при величине КП ниже указанной образцу присваивается статус «отрицательный», то есть антитела отсутствуют или их уровень ниже предела обнаружения тест-системы.
На основании многочисленных исследований, показавших, что более 80% вируснейтрализующих антител направлены к рецептор-связывающему домену (RBD) S-белка SARS-CoV-2, Временные методические рекомендации предлагают при оценке напряженности поствакцинального протективного иммунитета методом ИФА определять антитела к рецептор-связывающему домену (anti-RBD антитела) [1].
Согласно данным производителя вакцины, Спутник V – двухвекторная вакцина от коронавируса, созданная на основе аденовирусного вектора. В состав вектора встраивают ген, кодирующий S-белок вируса SARS-CoV-2 [11]. Таким образом, в образцах сыворотки крови вакцинированных пациентов, не перенесших COVID-19, могут присутствовать антитела только к белку S, но не к белку N. При этом антитела после вакцинации вырабатываются не только против участка RBD, но и против других эпитопов, расположенных на белке S. Кроме того, согласно Временным методическим рекомендациям, наличие поствакцинального иммунитета путем выявления антител IgG к SARS-CoV-2 возможно оценивать не ранее, чем через 4 недели после 1-й дозы вакцины [1].
Возможной причиной различий в результатах, полученных с использованием разных тест-систем и приведенных в Табл. 2, может быть отсутствие на момент забора крови антител к собственно фрагменту RBD. В то же время в таком образце сыворотки крови могут присутствовать антитела против других эпитопов, расположенных на субъединицах S1 или S2 белка S. Как указано в «Материалах и методах», промежуток времени между первой дозой вакцины и постановкой анализа на антитела для данной выборки не известен, и есть вероятность, что антитела на момент проведения анализа не сформировались в достаточном количестве для их определения методом ИФА (количество антител ниже предела обнаружения тест-системы). Поэтому в тест-системах, использующих полноразмерный белок S или субъединицу S1, могут быть получены положительные результаты при отрицательных результатах в тест-системе, использующей только фрагмент RBD белка S.
Для дальнейшего выяснения причины различий, полученных при исследовании рутинных образцов вакцинированных пациентов клинико-диагностической лаборатории, было проведено сравнительное исследование динамики появления антител IgG в иммуноферментном анализе с использованием тест-системы с белком S и тест-системы с фрагментом RBD белка S в составе твердой фазы. В качестве референтного метода выступала реакция нейтрализации вируса, которая оценивает наличие и уровень только нейтрализующих антител. Выборка добровольцев и сроки забора крови описаны в «Материалах и методах». В процессе исследования добровольцы прошли полный курс вакцинации «Гам-КОВИД-вак» (Спутник V).
Девять участников перенесли COVID-19 до вакцинации и имели положительные результаты по ИФА. У 5-ти из них обнаруженные антитела не были вируснейтрализующими (NAbs). В трех остальных случаях титр нейтрализующих антител оказался весьма низким от 1/10 до 1/40. На рис. 1 представлены данные по уровню выявленных двумя тест-системами антител, соответственно либо к фрагменту белка S – RBD, либо к полноразмерному белку S, и по титрам нейтрализующих антител у этих 9-ти добровольцев. Уже на 21-й день после начала вакцинации у данных добровольцев было обнаружено резкое увеличение титров вируснейтрализующих антител (до 1/80-1/1280) (показано сплошной линией) с дальнейшим ростом титра вплоть до 70-го дня. При определении уровня антител у этих людей иммуноферментным методом обе тест-системы показали в большинстве случаев сходную динамику, коэффициенты позитивности у каждого из участников за 3 недели изменились несущественно.
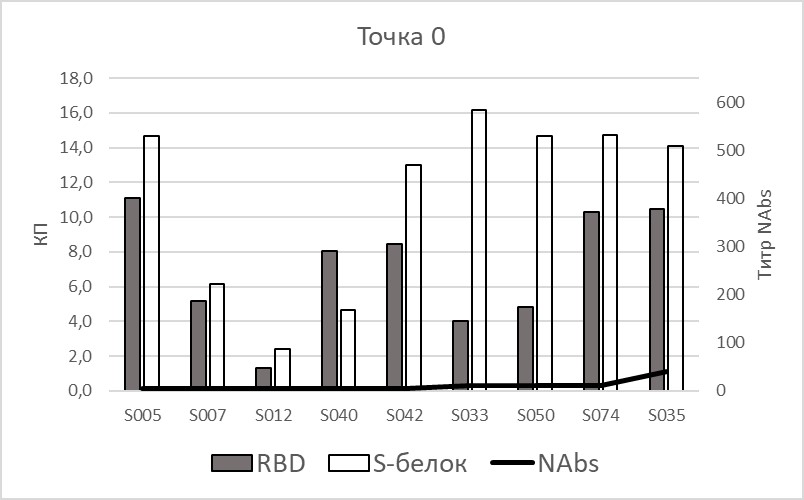 |
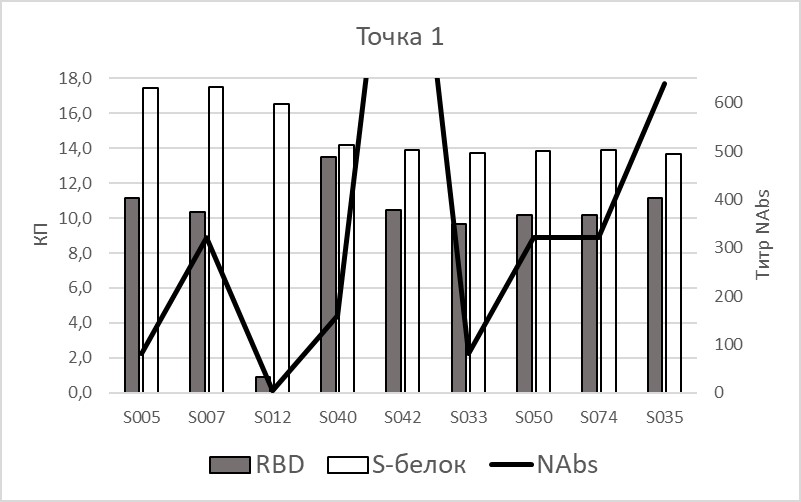 |
Рис. 1. Уровень коэффициентов позитивности IgG и титра вируснейтрализующих антител у участников исследования, перенесших COVID-19 до вакцинации, до введения 1-й дозы (слева) и на 21-й день (справа). По оси Х – коды образцов сыворотки крови, по оси Y – КП для ИФА-измерений и Титр NAbs для РМН. RBD – тест-система с фрагментом белка в составе твердой фазы, S-белок – тест-система с полноразмерным белком, NAbs – метод РМН.
Перед вакцинацией у 39-и добровольцев антитела отсутствовали, как при определении в наборах ИФА, так и методом РМН. Через 21 день после введения 1-й дозы вакцины результаты распределились следующим образом: вируснейтрализующие антитела с титром 1/10 обнаружены у 6-ти человек, 1/20 – у 3-х человек, 1/40 – у 1-го человека; все десять образцов сыворотки крови показали наличие антител методом ИФА с обоими вариантами белка S, как с полноразмерным, так и с фрагментом RBD. У 29-и человек нейтрализующие антитела отсутствовали. В то же время коммерческие наборы для иммуноферментного анализа в данных образцах продемонстрировали разнобой в трактовке результатов. В наборах с RBD из 29 образцов – 9 показали себя как отрицательные (отсутствие антител), 2 – как сомнительные (коэффициент позитивности находился в «серой зоне»), остальные как слабоположительные (незначительный уровень антител). В наборе c белком S только 1 из этих образцов – отрицательный, остальные – положительные (рис. 2).
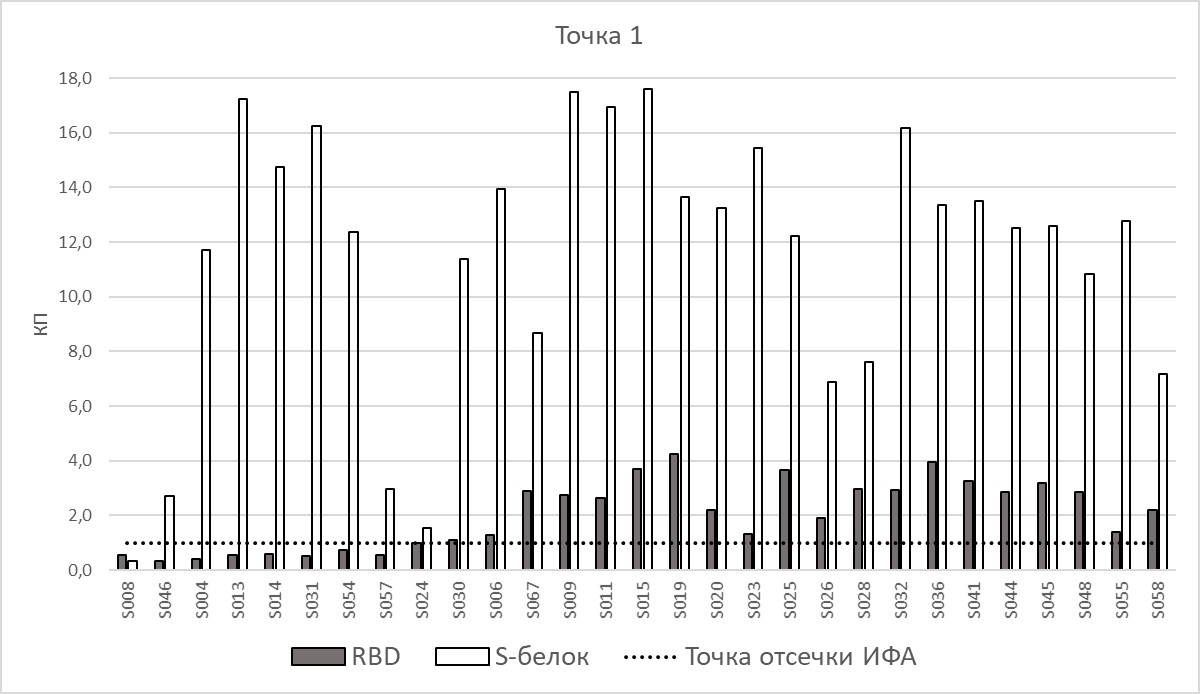
Рис. 2. Уровень коэффициентов позитивности IgG у добровольцев без COVID-19 в анамнезе на 21-й день после введения 1-й дозы вакцины. По оси Х – коды образцов сыворотки крови, по оси Y – КП для ИФА-измерений. RBD – тест-система с фрагментом белка в составе твердой фазы, S-белок – тест-система с полноразмерным белком. Точка отсечки ИФА - результат анализа, используемый в качестве критерия «положительного анализа»; результаты анализа, которые равны или выше этого результата анализа, считаются «положительными»; результаты, не равные или не превышающие этот результат, считаются «отрицательными».
Через 42 дня после начала вакцинации у всех 39-и участников без COVID-19 в анамнезе было показано наличие вируснейтрализующих антител. Прирост титров составил от 1/10 до 1/320. В среднем титр нейтрализующих антител вырос в 5 раз по сравнению 21-м днем от начала вакцинации. В наборах ИФА все образцы сыворотки крови содержали искомые антитела, хотя и с разными КП. При этом в наборах с фрагментом RBD наблюдалось увеличение КП «положительных» образцов в среднем в 3 раза по сравнению результатами 21-го дня, в наборе с белком S – в 1,5 раза (рис. 3).
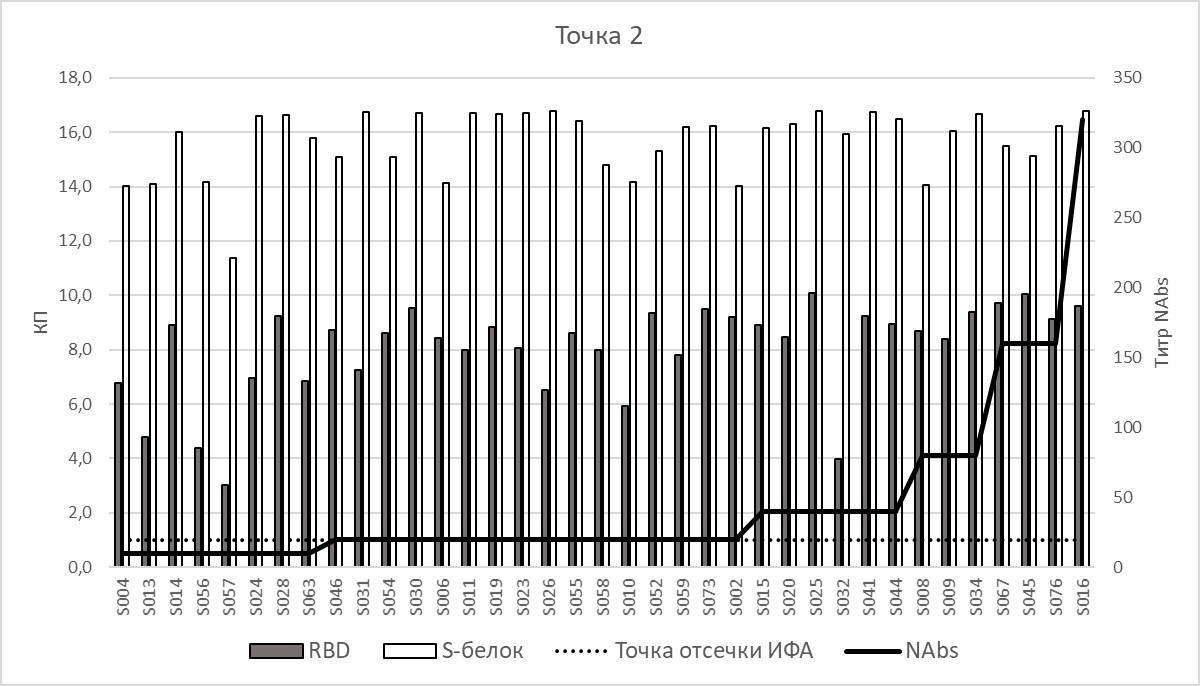
Рис. 3. Уровень коэффициентов позитивности IgG у добровольцев без COVID-19 в анамнезе на 42-й день после введения 1-й дозы вакцины. Обозначения см. рис. 2.
Через 70 дней средний титр нейтрализующих антител у участников наблюдения увеличился в 1,3 раза по сравнению с 42-м днем. Однако максимальный титр, 1/320, не был превышен. В обоих наборах ИФА, вне зависимости от состава антигенов на твердой фазе, значительной разницы по КП между 70-м и 42-м днем нет.
У 5-ти участников исследования, которые не болели COVID-19, но прошли полный курс вакцинации, нейтрализующие антитела не образовались совсем. Аналогичным образом тест-система ИФА, использующая только фрагмент RBD белка S, для трёх человек показала отсутствие антител или очень низкий их уровень (КП не выше 1,2), у двух участниковчерез 42 и 70 дней получены КП не более 6,0 (слабоположительные или среднеположительные). В то же время в наборе, использующем полноразмерный белок S, только для 1-участника были получены отрицательные результаты последовательно на всех сроках испытаний. Для остальных 4-х человек, начиная с 21-го дня после введения 1-й дозы эта тест-система показала высокие коэффициенты позитивности (более 8,0).
Отметим, что образование антител и прирост титра вируснейтрализующих антител после вакцинации в ходе формирования гуморального иммунитета происходит с разными скоростью и динамикой у каждого человека вне зависимости от пола или возраста.
Заключение
При определении антител IgG к вирусу SARS-CoV-2, клинико-диагностические лаборатории, работающие с тест-системами сразу нескольких производителей, сталкиваются с рядом противоречивых результатов у пациентов (таблица 2): например, отрицательные результаты у прошедших вакцинацию, положительные результаты в одной тест-системе и отрицательные результаты в другой тест-системе, разные коэффициенты позитивности (КП) в одном и том же образце сыворотки крови. В такой ситуации возникает вопрос, какой результат правилен и пригоден для выдачи пациенту или его лечащему врачу.
Выявление связывающих антител не обязательно дает вируснейтрализующий эффект и защиту от размножения вируса в клетках инфицированного хозяина, и традиционный метод РМН остается референтным стандартом по сей день [12]. Реакция микронейтрализации является стандартной процедурой при валидировании любого серо-эпидемиологического метода [13]. Она может быть использована в качестве референтного или подтверждающего при разработке тест-системы [6] или вакцины [14], для оценки клинической эффективности разработанной или коммерческой тест-системы [7, 8, 15, 16], для оценки популяционного иммунитета [9].
Обнаружение в образце сыворотки крови высокого уровня антител не обязательно свидетельствует о приобретении организмом защитного гуморального иммунитета. Что касается белка S вируса SARS-CoV-2, нейтрализующие антитела вырабатывается, в основном к участку RBD субъединицы S1, а в минорных количествах – к N-терминальному домену субъединицы S1 и одному эпитопу на субъединице S2 [17]; при этом не все антитела, образовавшиеся к участку RBD, являются нейтрализующими [6]. В поствакцинальный период нейтрализующие вирус SARS-CoV-2 антитела появляются достаточно поздно, вероятно, только через месяц после начала вакцинации [18]. В описанном случае максимальный прирост наблюдался через 42 дня после введения 1-й дозы вакцины, затем происходило замедления роста титров. У пациентов, переболевших COVID-19, на фоне проводимой вакцинации увеличение титров вируснейтрализующих антител до максимально определяемых значений происходило значительно раньше, уже после введения 1-й дозы вакцины.
Наибольшее сходство в динамике прироста коэффициентов позитивности с приростом титра вируснейтрализующих антител отмечено в тест-системе, использующей на твердой фазе только фрагмент RBD белка S, по сравнению с тест-системой, использующей в своем составе полноразмерный белок S. О том же говорят исследования последнего года продолжающейся пандемии [6, 7, 16].
Уровень антител, определяемый как коэффициент позитивности, в тест-системе, использующей полноразмерный белок S, для категории людей, не болевших и проходящих вакцинацию «ГАМ-КОВИД-вак», не коррелируют с динамикой изменения вируснейтрализующих антител. Коэффициенты позитивности антител, определяемые в тест-системе, использующей фрагмент RBD, в большей степени коррелируют с нарастанием титра вируснейтрализующих антител. Как указано выше [1, 18], нейтрализующие антитела появляются на поздней стадии формирования гуморального иммунитета, в отличие от связывающих антител. Соответственно, данные, представленные в табл. 1, отставание по уровню коэффициентов позитивности, определенных в тест-системе с составом антигенов-мишеней «N+RBD», можно частично объяснить отсутствием на момент забора крови именно нейтрализующих антител. В то время как тест-системы с полноразмерными белками способны обнаруживать ненейтрализующие антитела [7].
Пациенты, переболевшие до вакцинации COVID-19 естественным образом, имеют антитела ко всем белкам, указанным во введении, в том числе к белку N. Таким образом, у тех пациентов, которые на момент начала исследования (перед вакцинацией) не имели вируснейтрализующих антител, то есть anti-RBD антител, но демонстрировали существенный уровень общих антител, выявленных методом ИФА, в плазме крови могли циркулировать антитела к белку N, которые и могли быть выявлены этой коммерческой тест-системой. Данные исследования показали, что фрагмента RBD достаточно для правильной интерпретации результатов вакцинации при применении векторной вакцины «Гам-КОВИД-Вак» и ее производных «Гам-КОВИД-Вак-Лио» и «Спутник Лайт».
Литература:
1. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 11 (07.05.2021). Министерство здравоохранения Российской Федерации.
2. Супотницкий М.В. Новый коронавирус SARSCoV-2 в аспекте глобальной эпидемиологии коронавирусных инфекций // Вестник войск РХБ защиты. 2020. Т. 4. № 1. С. 32-65.
3. Ou, X., Liu, Y., Lei, X. et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV // Nat Commun 11, 1620 (2020).
4. Zeng W, Liu G, Ma H, et al. Biochemical characterization of SARS-CoV-2 nucleocapsid protein // Biochem Biophys Res Commun. 2020 Jun 30; 527(3):618-623.
5. Комбарова С. Ю., Алешкин А. В., Новикова Л. И., и др. Динамика антител к различным антигенам коронавируса SARS-CoV-2 у больных с подтвержденной инфекцией Covid-19 // COVID19-PREPRINTS.MICROBE.RU.
6. Perera RA, Mok CK, Tsang OT, et al. Serological assays for severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2), March 2020 // Euro Surveill. 2020 Apr; 25 (16):2000421.
7. Jääskeläinen AJ, Kuivanen S, Kekäläinen E., et al. Performance of six SARS-CoV-2 immunoassays in comparison with microneutralisation // J Clin Virol. 2020 Aug; 129:104512.
8. Walker GJ, Naing Z, Ospina Stella A, et al SARS Coronavirus-2 Microneutralisation and Commercial Serological Assays Correlated Closely for Some but Not All Enzyme Immunoassays // Viruses. 2021 Feb 4; 13 (2):247.
9. Haveri A, Smura T, Kuivanen S, et al. Serological and molecular findings during SARS-CoV-2 infection: the first case study in Finland, January to February 2020 // Euro Surveill. 2020 Mar; 25(11): 2000266.
10. Denis Y Logunov, Inna V Dolzhikova, Olga V Zubkova, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia// The Lancet. Vol 396 September 26, 2020.
11. https://sputnikvaccine.com [Электронный ресурс].
12. Klasse PJ. Neutralization of Virus Infectivity by Antibodies: Old Problems in New Perspectives. // Adv Biol. 2014; 157895.
13. Rathe JA, Hemann EA, Eggenberger J, et al. SARS-CoV-2 Serologic Assays in Control and Unknown Populations Demonstrate the Necessity of Virus Neutralization Testing // J Infect Dis. 2021 Apr 8;223(7):1120-1131.
14. Emary KRW, Golubchik T, Aley PK, et al. Efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine against SARS-CoV-2 variant of concern 202012/01 (B.1.1.7): an exploratory analysis of a randomised controlled trial // Lancet. 2021 Apr 10; 397 (10282):1351-1362.
15. Rubio-Acero R, Castelletti N, Fingerle V, et al. In Search of the SARS-CoV-2 Protection Correlate: Head-to-Head Comparison of Two Quantitative S1 Assays in Pre-characterized Oligo-Asymptomatic Patients // Infect Dis Ther. 2021 Sep; 10 (3):1505-1518.
16. Suhandynata RT, Hoffman MA, Huang D, et al Commercial Serology Assays Predict Neutralization Activity against SARS-CoV-2 // Clin Chem. 2021 Jan 30; 67 (2):404-414.
17. Piccoli L, Park YJ, Tortorici MA, et al. Mapping Neutralizing and Immunodominant Sites on the SARS-CoV-2 Spike Receptor-Binding Domain by Structure-Guided High-Resolution Serology // Cell. 2020 Nov 12; 183 (4):1024-1042.e21.
18. Claro F, Silva D, Rodriguez M, et al. IgG Antibody response to the Sputnik V vaccine: previous SARS-CoV-2 seropositive individuals might need just one vaccine dose // Int J Infect Dis. 2021 Jul 31:S1201-9712(21)00626-3.