ЦИТОЛОГИЯ, 2021, том 63, № 5
Оригинальная статья
УДК 576.3/.53/.7
КОРРЕКЦИЯ ПОСТИШЕМИЧЕСКИХ ИЗМЕНЕНИЙ МИКРОЦИРКУЛЯЦИИ В КОРЕ ГОЛОВНОГО МОЗГА КРЫС
С ПОМОЩЬЮ МЕЗЕНХИМНЫХ СТВОЛОВЫХ КЛЕТОК
И. Б. Соколова1, *, О. П.Горшкова1, Н. Н. Павличенко2
1Институт физиологии имени И.П. Павлова РАН,
Санкт-Петербург,199034 Россия
2ООО «Транс-Технологии»», Санкт-Петербург, 192148, Россия
*Email: SokolovaIB@infran.ru
Цель исследования – выяснить, как влияет внутривенная трансплантация мезенхимных стволовых клеток человека (МСКч), проведенная в день ишемии/реперфузии, на плотность сосудистой сети, реактивность пиальных артерий и тканевую перфузию в коре головного мозга через 7, 14 и 21 сут. после ишемического воздействия.
С помощью установки для изучения микроциркуляции исследовали плотность всей микрососудистой сети и плотность артериальных сосудов в пиальной оболочке сенсомоторной коры крыс, перенесших ишемию/реперфузию (И/Р) головного мозга, после внутривенной трансплантации МСКч. На этой же установке исследовали реактивность пиальных артерий на воздействие ацетилхолина (ACh). Параллельно с помощью лазерного допплерографа «ЛАКК-М» в сенсомоторной коре измеряли показатель перфузии (П). Наиболее значительно плотность всей микрососудистой сети и плотность артериальных сосудов понизились по сравнению с ложнооперированными (ЛО) крысами в первые 7 сут. после И/Р: в среднем в 1.6 и 1.4 раз соответственно. Через 14 сут. эти показатели составляли 1.4 и 1.2 раза, а через 21 сут. – 1.2 и 1.3 раза. У животных, перенесших И/Р, значительно ухудшалась реактивность пиальных артерий на ACh. Через 7 сут. после И/Р количество дилатирующих артерий понизилось в 1.4—1.7 раза, через 14 сут – в 1.6—1.9 раза, через 21 сут. – в 1.2—1.7 раза. При этом через 21 сут. статистически значимо понижался уровень П в среднем в 1.6 раза. Внутривенное введение МСКч привело к сохранению плотности микрососудистой сети пиальной оболочки у крыс на всех сроках после И/Р на уровне контрольных животных. Реактивность в группе клеточной терапии также не отличалась от контрольных значений. Уровень П через 21 сут. после И/Р был ниже, чем в ЛО группе в 1,2 раза, но статистически значимо выше, чем у крыс с ишемическим повреждением головного мозга без введения МСКч.
Заключение: внутривенная трансплантация МСКч позволила предотвратить деградацию микрососудистого русла в коре головного мозга крыс после И/Р и сохранить реактивность пиальных артерий на уровне контрольных животных.
Ключевые слова: ишемия/реперфузия, головной мозг, внутривенная трансплантация, мезенхимные стволовые клетки, плотность микрососудистого русла, реактивность, перфузия
Принятые сокращения: АД – артериальное давление; ЛО – ложнооперированные крысы; МСК и МСКч – мезенхимные стволовые клетки и МСК человека соответственно; П – показатель перфузии; И/Р – ишемия/реперфузия; ТИА – транзиторные ишемические атаки; ЭД – эндотелиальная дисфункция; AСh – ацетилхолин.
Нарушение мозгового кровообращения вследствие образования тромба или длительного спазмирования церебральных артерий – одно из наиболее распространенных патологических состояний в современной повседневной жизни (Шляхто и др., 2012). Примерно в 30% случаев развитию инсульта предшествуют кратковременные преходящие нарушения мозгового кровообращения, не приводящие к развитию инфаркта, так называемые транзиторные ишемические атаки (ТИА). Одним из основных факторов, определяющих исход и отдаленные последствия ТИА, является состояние мозговой гемодинамики – степень ее нарушения и выраженность компенсаторных механизмов. Возникновение повторных ишемических поражений головного мозга во многом связывают с формированием микро- и макроангиопатий, приводящих к развитию гемодинамических нарушений, в основе которых лежит эндотелиальная дисфункция (ЭД). К настоящему времени доказано, что эндотелиальные клетки принимают участие во многих процессах регуляции гемостаза и микроциркуляции (Манухина, Малышев, 2003, Gimbrone, Garcia-Cardena, 2016). Развитие ЭД приводит к дисбалансу выработки веществ, вызывающих вазодилатацию и вазоконстрикцию, усиливаются пролиферация гладкомышечных клеток, процессы адгезии и тромбообразования. Стенки мозговых артерий теряют эластичность, утолщаются, уменьшается сосудистый просвет, что может вызывать ухудшение снабжения ткани головного мозга кислородом.
Разработка способов восстановления мозговой микроциркуляции и функций эндотелия церебральных сосудов при различных патологиях – актуальная задача современных медицины и биологии. Применение с этой целью мезенхимных стволовых клеток (МСК) является инновационным и очень перспективным подходом. В многочисленных работах за последние 30 лет показано, что трансплантация МСК после ишемических или травматических повреждений головного мозга приводит к уменьшению объема поврежденной ткани, сохранению функции нейронов в пограничной с повреждением зоне, восстановлению микроциркуляции (Feng et al., 2016; Fitzsimmons et al., 2018). Применение МСК для восстановления функции эндотелия церебральных сосудов после ТИА – практически не исследованный путь коррекции постишемических осложнений. К настоящему времени в работах invitro и invivo доказано, что МСК способны модулировать воспалительные (Newman et al.,2009), иммунные процессы и окислительный стресс (Calio et al., 2014), особенно в условиях ишемии. В отдельных работах показано, что МСК могут дифференцироваться в эндотелиальные клетки (Pu et al., 2016) и оказывать протекторное воздействие на эндотелиальные клетки церебральных сосудов после ишемического инсульта (Chung et al., 2015; Liu et al., 2019).
Цель исследования – выяснить, как влияет внутривенная трансплантация МСКч, проведенная в день ишемии/реперфузии, на плотность сосудистой сети, реактивность пиальных артерий и тканевую перфузию в коре головного мозга через 7, 14 и 21 сут. после ишемического воздействия.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проведена на животных из биоколлекции «Коллекция лабораторных млекопитающих разной таксономической принадлежности» Института физиологии им. И.П. Павлова РАН, поддержанной программой биоресурсных коллекций ФАНО России. Исследования проводили в соответствии с регламентом, установленным МЗСР РФ № 708н от 23.08.10 («Правила лабораторной практики»), Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях, и рекомендациями биоэтической комиссии Института физиологии им. И.П. Павлова РАН.
Животные. Эксперименты проведены на крысах-самцах Wistar (n = 85). Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище.
Ишемия/реперфузия. У наркотизированных хлоралгидратом (внутрибрюшинно, 43 мг/100 г массы тела) крыс ишемию воспроизводили с использованием техники 12-минутной окклюзии обеих сонных артерий с одновременной управляемой гипотензией (снижение и строгое поддержание артериального давления (АД) на уровне 45 ± 3 мм рт. ст. путем забора/реинфузии крови в гепаринизированный шприц). Прямое измерение АД производили через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур), подключенным к компьютеру, работающему с оригинальной программой визуализации значений АД, разработанной в нашей лаборатории. По окончании периода ишемии производили полную реинфузию забранной крови. После ушивания операционных ран и выхода из наркоза (на подогреваемых столиках) животных возвращали в клетки обычного содержания.
МСКч и их трансплантация. Для внутривенной трансплантации использовали мезенхимные стволовые клетки человека (МСКч), полученные от одного донора. Выделение МСК из костного мозга, их культивирование и фенотипирование проводили в ООО «Транс-Технологии» по стандартным, общепринятым методикам с минимальными изменениями (Azizi et al., 1998, Penfornis P, Pochampally R., 2011). В частности, для культивирования МСКч использовали питательную среду α-МЕМ (Hyclone, Новая Зеландия), с добавлением 20% сыворотки крови эмбрионов коров (Gibco, США) и 100 мкг/мл пенициллина/стрептомицина (Gibco, США). Фенотипирование МСКч проводили методом проточной цитофлуориметрии на проточном цитофлуориметре FACSscan (Beckton Dickinson, США). МСКч окрашивали с помощью антител против позитивных маркеров CD90, CD105, CD44, CD73 и антител против негативных маркеров CD45, CD34, CD14, CD11b, HLA-DR и 7AAD (Beckton Dickinson, США). Для трансплантации использовали МСКч на 2—3 пассажах. Внутривенная трансплантация была проведена крысам через 1 час после И/Р головного мозга. Каждому животному было введено 5 млн МСКч в 30 мкл культуральной среде.
Все последующие хирургические и экспериментальные действия были проведены на наркотизированных внутрибрюшинно (золетил (20 мг/кг) (Virbac, Франция)) крысах; эвтаназия проведена путем введения увеличенной дозы золетила.
Группы животных. 1. Контрольная группа: ложнооперированные (ЛО) крысы Вистар, которые подвергались оперативному вмешательству, но без проведения И/Р. Исследования плотности сосудистой сети, реактивности пиальных артерий и перфузии в сенсомоторной коре у данной и всех последующих групп на отдельных подгруппах животных (острые опыты) были проведены через 7, 14, 21 сут. после хирургического воздействия. Вес крыс и АД на 7 сут. (n = 9) составляли 245±13,8 г и 139±5,6 мм рт. ст. соответственно, на 14 сут. (n = 10) - 303±12,7 г и 133±4,6 мм рт. ст. соответственно, на 21сут. (n = 9) - 330±12,2 г и 135±2 мм рт. ст. соответственно.
2. Крысы Вистар, которым была проведена И/Р головного мозга. Вес и АД на 7 сут. (n = 9) составляли 259±12,1 г и 149±4,7 мм рт. ст. соответственно, на 14 сут (n = 8) - 256±5,2 г и 133±5,3 мм рт. ст. соответственно и на 21 сут. (n = 9) - 318±4,2 г и 124±3,9 мм рт. ст. соответственно.
3. Крысы Вистар, которым была проведена И/Р головного мозга и внутривенно введены МСКч. Вес и АД на 7 сут. (n = 9) составляли 250±11,3 г и 144±4,1 мм рт. ст. соответственно, на 14 сут (n = 10) - 306±9,9 г и 134±4,9 мм рт. ст. соответственно и на 21 сут. (n = 12) - 327±6,3 г и 123±5,7 мм рт. ст. соответственно.
Визуализация и мониторинг микрососудистой сети. Для проведения прижизненного исследования реакций пиальных артерий в теменной области черепа животного высверливали отверстие (S ≈ 1 см2). Твердую мозговую оболочку в пределах отверстия удаляли, тем самым открывая поле для дальнейшего исследования. Поверхность мозга непрерывно орошали раствором Кребса (pH 7.4), температура которого составляла 37°C. На протяжении всего эксперимента контролировали среднее АД, показатели которого в течение всего эксперимента оставались примерно на одном уровне и составляли 134 ± 5 мм рт. ст. Температуру тела животных в течение всего опыта поддерживали на уровне 38оC. Визуализацию пиальных артерий проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM («Микромед», Россия), цветную камеру – видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер. На статических изображениях с помощью компьютерной программы для цитофотометрии «Photo M» (авторская разработка А. Черниговского, http://www.t_lambda.chat.ru) определяли количество артерий и общее количество микрососудов на определенной площади. Затем измеряли диаметры пиальных артериальных сосудов. В ходе эксперимента у каждого животного было исследовано более 40 пиальных артерий. Диаметр артерий фиксировали в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса и при орошении мозга раствором ацетилхолина (AСh) (10-7М/л) (Sigma-Aldrich, USA). Экспериментально показано, что пиальные микрососуды разного диаметра реагируют на воздействие ACh не одинаково: чем меньше исходный диаметр, тем больше реакция (Горшкова и др., 2016). В связи с этим мы также разбили все исследованные пиальные артериальные микрососуды на группы: более 40 мкм, 20—40 мкм, менее 20 мкм. О результатах воздействия ACh судили по количеству расширившихся артериальных сосудов и по степени их расширения.
У тех же экспериментальных животных с помощью многофункционального лазерного диагностического комплекса ЛАКК-М («ЛАЗМА», Россия) измеряли перфузию (П) в ткани коры головного мозга. Датчик прибора размещали в 3х точках над сенсомоторной корой с приблизительными координатами АР = 1, 2, 3 мм от брегмы; SD = 1.0 мм латерально от сагиттального шва. Прилагаемое к комплексу ЛАКК-М программное обеспечение автоматически рассчитывало среднюю величину показателя микроциркуляции – П.
Статистическая оценка данных. Математическая обработка полученных данных проведена с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 («GraphPad Software Inc.», США). Данные представлены в виде среднего арифметического значения и его ошибки. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) рассчитывали при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. При распределении вариант в выборке, при распределении отличном от нормального, при сравнении групп применяли критерий Краскела-Уоллиса с последующим попарным сравнением групп согласно критерию Данна. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ
Анализ культуры МСКч методом проточной цитофлуориметрии показал, что она состояла на 99.7% из CD90+, CD73+, CD105+, CD44+-клеток (собственно МСК), на 0.3% CD45+, CD34+- клеток (клетки гемопоэтического ряда) и на 0.5% из CD14+, CD11b+, HLA-DR+. 7AAD+-клеток (нежизнеспособных) было не более 0.9—1%.
|
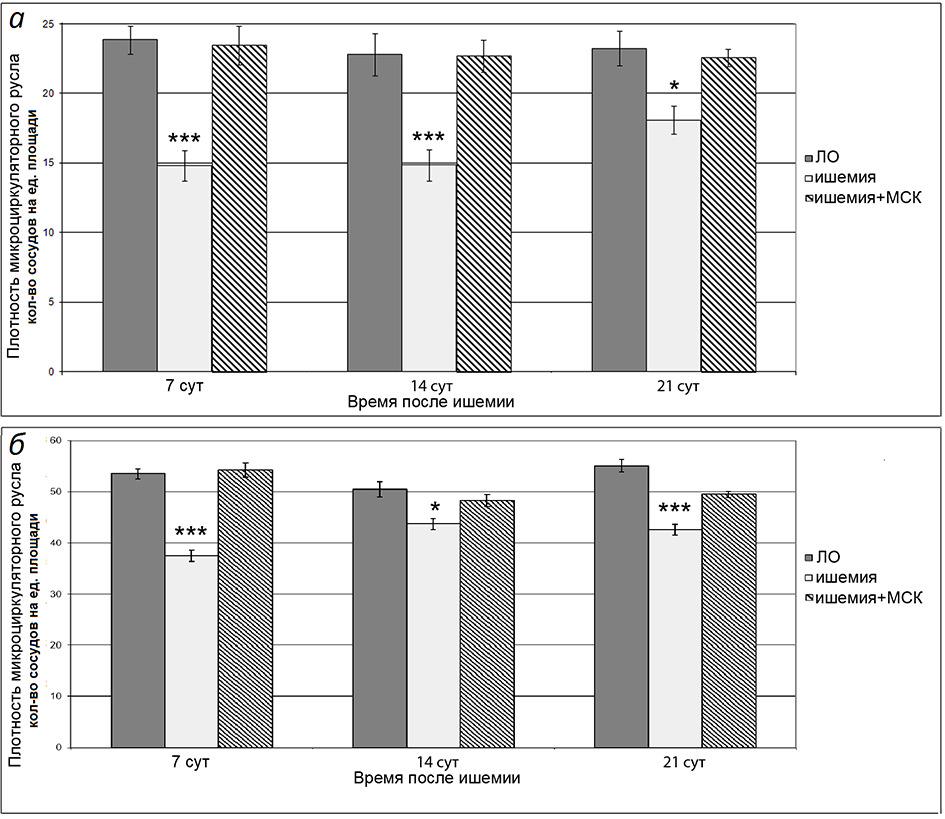
Результаты исследования плотности микрососудистой сети пиальной оболочки сенсомоторной коры у ЛО и крыс, перенесших И/Р головного мозга, представлены на рисунке 1. После И/Р у крыс плотность всей микрососудистой сети и плотность артериальных сосудов наиболее значительно понижались по сравнению с ЛО в первые 7 сут. – в среднем в 1.6 и 1.4 раз соответственно. Через 14 сут. плотность всей микрососудистой сети и плотность артериальных сосудов были ниже, чем в ЛО группе соответственно в 1.4 и 1.2 раза, а через 21 сут. – в 1.2 и 1.3 раза. В группе животных, перенесших И/Р, которым была проведена внутривенная трансплантация МСКч, плотность микрососудистой сети пиальной оболочки сохранилась в полном объеме на уровне ЛО крыс в течение всего периода исследования.
|
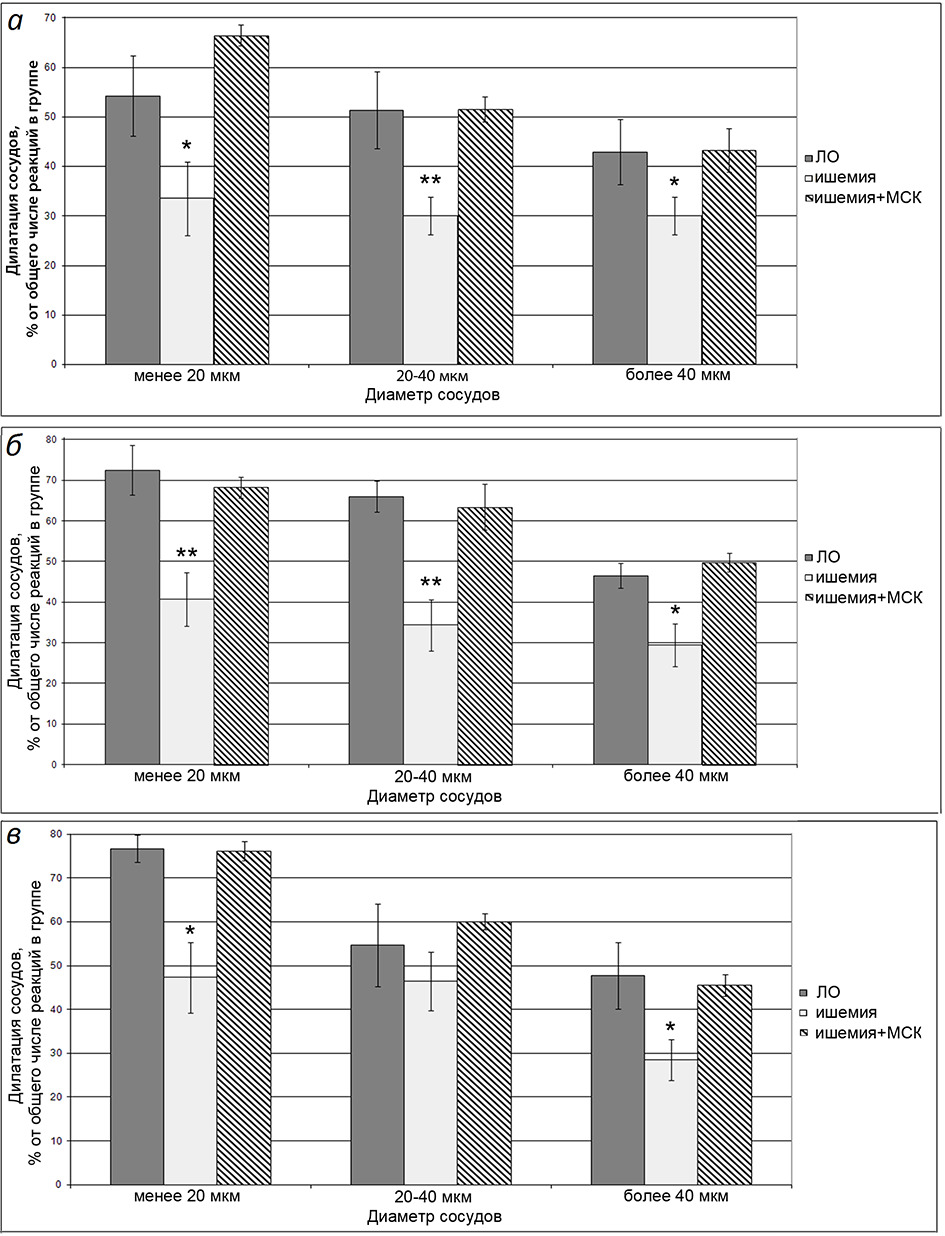
В группе животных, перенесших И/Р головного мозга, мы выявили значительное ухудшение реактивности стенок пиальных артерий при аппликации на поверхность мозга ACh (рис. 2). У крыс из этой группы, число артериальных сосудов, ответивших расширением (увеличением диаметра) на воздействие ACh, через 7 сут. понизилось в 1.4—1.7 раза, через 14 сут – в 1.6—1.9 раза, через 21 сут. – в 1.2—1.7 раза по сравнению с ЛО крысами. По степени изменения диаметров (данные не показаны) не было выявлено различий между группами животных. Применение МСКч позволило сохранить реактивность пиальных артерий на уровне ЛО животных. Как видно из рис. 2 в группе клеточной терапии расширением на воздействие ACh ответило столько же артериальных микрососудов, сколько и в контрольной группе. Степень их расширения была такой же, как у ЛО животных.
|
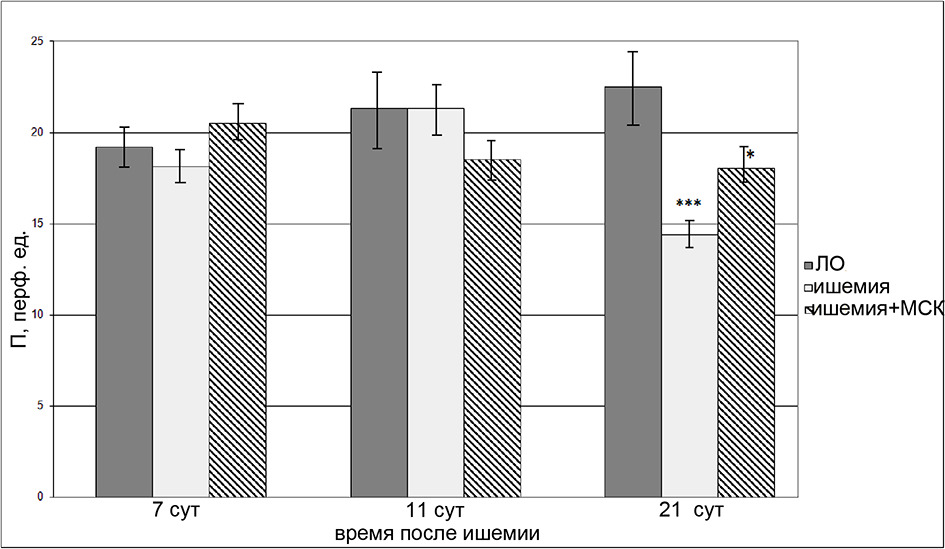
Уровень П в ткани сенсомоторной коры через 7 и 14 сут. у всех животных, перенесших И/Р головного мозга, оставался примерно таким же, как у ЛО крыс (рис. 3). На 21 сут. после И/Р мы выявили значительное понижение П в среднем в 1.6 раза в группе крыс, подвергнутых только И/Р. У животных из группы клеточной терапии на 21 сут. после ишемии также было выявлено понижение П, но менее значимое (в среднем в 1.2 раза).
ОБСУЖДЕНИЕ
К нарушению функций нейрососудистой единицы при церебральной ишемии приводит как резкое понижение кровотока в ткани мозга, так и его восстановление (Bai, Lyden, 2015; Kalogeris et al., 2017). Оптимальная терапевтическая стратегия при лечении последствий ишемии – минимизировать развитие таких патологических процессов, как воспаление, окислительный стресс, нарушение метаболизма, эндотелиальная дисфункция. Применение МСК позволяет купировать тканевое воспаление (Newman et al., 2009) и развитие окислительного стресса (Calio et al., 2014). МСК выделяют нейропротекторные вещества (Mahmood et al., 2004). В последние годы в зарубежной литературе появился ряд публикаций, доказывающих, что трансплантация МСК восстанавливает функцию эндотелия мозговых сосудов (Chung et al., 2015; Abumaree et al., 2017). Ранее на старых, спонтанно гипертензивных крысах и на животных, перенесших нефрэктомию, мы наблюдали восстановление плотности микрососудистого русла пиальной оболочки, функций эндотелия пиальных артерий и П в коре головного мозга в течение года после интрацеребральной или внутривенной трансплантации МСК (Соколова, Полынцев, 2017; Соколова, Павличенко, 2020). Такой же положительный эффект от внутривенной трансплантации МСК в день моделирования ишемического воздействия мы наблюдаем и в представленном исследовании. У крыс, перенесших И/Р через 7, 14 и 21 сут. плотность всей микрососудистой сети пиальной оболочки снижалась в 1.4, 1.2, 1.3 раза соответственно; плотность артериального участка – в 1.6, 1.4 и 1.2 раза соответственно. После клеточной терапии у животных полностью сохранялась сосудистая сеть пиальной оболочки в течение всего периода наблюдений (рис. 1). Вероятно, в данном случае мы имеем дело именно с сохранением нативных сосудов (особенно в первые 7 сут.), связанным с выделением МСК протекторных факторов. Наиболее значимо то, что с помощью МСК удалось не просто сохранить структуру микрососудистой сети, но и предотвратить развитие ЭД. Ишемическое воздействие резко негативно повлияло на состояние эндотелиальных клеток пиальных артерий (рис. 2): на воздействие ацетилхолина на 7, 14 и 21 сут. после И/Р головного мозга расширением ответило в 1.2—1.9 раза меньше сосудов, чем у контрольных крыс. Ранее нами было показано, что через 7 дней после ишемии в периферической крови отмечается увеличение содержания циркулирующих эндотелиальных клеток, что может быть связано с усилением десквамации эндотелиальных клеток в результате повреждения эндотелия (Горшкова и др., 2016). Нарушение целостности эндотелиального слоя в этот отрезок постишемического периода может быть причиной наблюдающегося в дальнейшем ухудшения вазодилататорных эндотелий-зависимых сосудистых реакций на ACh. Следовательно, кратковременная ишемия приводит к развитию ЭД в пиальных артериальных сосудах и к 21 сут. восстановления функции эндотелия не произошло. Применение МСК позволило полностью предотвратить развитие ЭД у ишемизированных животных в течение всего периода наблюдений (рис. 2). Эндотелиальные клетки секретируют ряд вазоактивных веществ, поддерживая гомеостаз сосудистой стенки и модулируя сосудистый ответ на эндогенные и экзогенные воздействия (Ierssel et al., 2015). Скорость тканевого кровотока регулируется расслаблением/сокращением гладкомышечных клеток в стенке артерий. Для адекватного обеспечения кислородом в ткани головного мозга должен поддерживаться определенный уровень скорости кровотока, интегральным показателем которого является измеряемая нами перфузия (П). Статистически значимое понижение П мы наблюдали у всех крыс, перенесших И/Р головного мозга только на 21 сут. В группе животных, которым была проведена только И/Р П понизилась примерно в 1,6 раза по сравнению с ЛО крысами. В группе клеточной терапии понижение П было менее выражено: в среднем в 1,2 раза ниже, чем у ЛО животных, но статистически значимо выше, чем у крыс, перенесших только И/Р. Показатель П прямо пропорционален скорости и количеству эритроцитов в зондируемом тканевом объеме (Крупаткин, Сидоров, 2013). Сохранение уровня П у крыс после И/Р головного мозга в первые 14 сут. может быть связано с увеличением линейной скорости кровотока и/или с явлениями застоя крови в сосудах коры головного мозга. Возможные механизмы ухудшения П к 21 сут. могут включать понижение плотности микрососудистой сети, сдавливание просвета сосудов набухшими отростками астроцитов, внутрисосудистое скопление эритроцитов, тромбоцитов, лейкоцитов (Bai, Lyden, 2015).
Положительный эффект от клеточной терапии мы, как и другие исследователи (Kalogeris et al., 2017), связываем с паракринной функцией МСК.
Итак, внутривенная трансплантация МСКч после ишемии/реперфузии привела к сохранению структуры микрососудистой сети пиальной оболочки коры головного мозга и предотвратила развитие эндотелиальной дисфункции в пиальных артериях.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа финансово поддержана Программой «Фундаментальные научные исследования для долгосрочного развития и обеспечения
конкурентоспособности общества и государства» (47_110_ДРиОК).
Тема 64.1 (0134-2019-0001) Раскрытие механизмов взаимодействия молекулярно-клеточных и системных регуляций функций внутренних органов.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Эксперименты на крысах проводили в соответствии с регламентом, установленным МЗСР РФ № 708н от 23.08.10 («Правила лабораторной практики») и Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях, и рекомендациями биоэтической комиссии Института физиологии им. И.П. Павлова РАН.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
Пожалуйста, уменьшите процент ссылок на работы авторов статьи (до 15-20%), сейчас – 27%, даже без учета пропущенной ссылки на работу Pavlichenkoetal., 2008).
Горшкова О.П., Шуваева В.Н., Ленцман М.В., Артемьева А.И. 2016. Постишемические изменения вазомоторной функции эндотелия. Современные проблемы науки и образования. Т. 5. URL: http://www.science-education.ru. (Gorshkova O.P., Shuvaeva V.N., Lensman M.V., Artem'eva A.I. 2016. Post-ischemic changes in the vasomotor function of endothelium. Sovremennye problemy nauki I obrazovaniya. V. 5.)
Крупаткин А.И., Сидоров В.В. Функциональная диагностика состояния микроциркуляторно-тканевых систем (Руководство для врачей). 2013. М.: Либроком. (Krupatkin A.I., Sidorov V.V. Functional diagnostics of state of microcirculatory-tissue systems (Guidelines for physicians). 2013. M.: Librocom.)
Манухина Е.Б., Малышев И.Ю. 2003. Роль оксида азота в развитии и предупреждении дисфункции эндотелия. Вестник ВГМУ. Т. 2. № 2. С. 5. (ManukhinaE.B., MalyshevI.Yu. 2003. The role of nitrogen oxide in the progression and prevention of endothelial dysfunction. Vestnik VGMU. V. 2. № 2. P. 5.)
Соколова И.Б., Павличенко Н.Н. 2020. Эффективность применения мезенхимных стволовых клеток для улучшения микроциркуляции в коре головного мозга нефрэктомированных крыс. Цитология. Т. 62. № 6. С. 410. (Sokolova I.B., Pavlichenko N.N. 2020. The efficacy of mesenchymal stem cells transplantation for improvement of microcirculation in the cerebral cortex of nephrectomized rats. Cell Tiss. Biol. (Tsitologiya). V. 62. № 6. P. 410.)
Соколова И.Б., Полынцев Д.Г. 2017б. Эффективность применения МСК для улучшения микроциркуляции в коре головного мозга спонтанно гипертензивных крыс. Цитология. Т. 59. № 4. С. 279. (Sokolova I.B., Polyntsev D.G. 2017. The efficacy of mesenchymal stem cells for the improvement of cerebral microcirculation in spontaneously hypertensive rats. Cell Tiss. Biol. (Tsitologiya). V. 59. № 4. P. 279.)
ШляхтоЕ.В., БаранцевичЕ.Р., ЩербакН.С., ГалагудзаМ.М. 2012. Молекулярные механизмы формирования ишемической толерантности головного мозга. Часть 1. Вестник РАМН. Т. 6. С. 42. (Shlyakhto E.V., Barantsevitch E.R., Shcherbak N.S., Galagudza M.M. 2012. Molecular mechanisms of development of cerebral tolerance to ischemia. Part 1. Annals of the Russian academy of medical sciences. V. 6. P. 42.)
Abumaree M., Hakami M., Abomaray F. 2017. Human chorionic villous mesenchymal stem/stromal cells modify the effects of oxidative stress on endothelial cell functions. Placenta. V. 59. P. 74.
Azizi S.A., Stokes D., Augelli B.J., DiGirolamo C., Prockop D.J. 1998. Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats--similarities to astrocyte grafts. Proc Natl Acad Sci U S A. V.95. №7. P. 3908.
Bai J., Lyden P. 2015. Revisiting cerebral postischemic reperfusion injury: New insights in understanding reperfusion failure, hemorrhage, and edema. Int J Stroke. V. 10. P. 143.
Calio M., Marinbo D., Ko G., Ribeiro R., Carbonel A., Oyama L., Ormanji M., Guirao T., Calio P., Reis L., Simoes M., Lisboa-Nascimento T., Ferreira A., Bertoncini C. 2014. Transplantation of bone marrow mesenchymal stem cells decreases oxidative stress, apoptosis, and hipppocampal damage in brain of a spontaneous stroke model. Free Radical Biol Med. V. 70. P. 141.
Chung T., Kim J., Choi B. 2015. Adipose-derived mesenchymal stem cells reduce neuronal death after transient global cerebral ischemia through prevention of blood-brain barrier disruption and endothelial damage. Stem Cells Trans. Med. V. 4. P. 178.
Feng N., Hao G., Yang F., Qu F., Zheng H., Liang S., Jin Y. 2016. Transplantation of mesenchymal stem cells promotes the functional recovery of the central nervous system following cerebral ischemia by inhibiting myelin-associated inhibitor expression and neural apoptosis. Exp. Therap. Med. V. 11. P. 1595.
Fitzsimmons R., Mazurek M., Soos A., Simmons C. 2018. Mesenchymal stromal/stem cells in regenerative medicine and tissue engineering. Stem Cells Intern. 2018: 8031718. https://doi.org/10.1155/2018/8031718
Gimbrone M., Garcia-Cardena G. 2016. Endothelial cell dysfunction and the pathology of atherosclerosis. Circ. Res. V. 118. P. 620.
Ierssel S., Conraads V., Craenenbroeck E., Liu Y., Maas A., Parizel P., Hoymans V., Vrints C., Jorens P. 2015. Endotheliai dysfunction in acute brain injury and the development of cerebral ischemia. J Neurosci. Res. V. 93. P. 866.
Kalogeris T., Baines C., Krenz M., Korthuis R. 2016. Ischemia/Reperfusion. 2017. Compr. Physiol. V. 7. P. 113.
Liu K., Guo L., Zhou Z., Pan M., Yan C. 2019. Mesenchymal stem cells transfer mitochondria into cerebral microvasculature and promote recovery from ischemic stroke. Microvasc Res. V. 123. P. 74.
Mahmood A., Lu D., Chopp M. 2004. Intravenous administration of marrow stromal cells (MSCs) increases the expression of growth factors in rat brain after traumatic brain injury. J. Neurotrauma. V. 21. P. 33.
Newman R., Yoo D., LeRoux M. 2009. Treatment of inflammatory diseases with mesenchymal stem cells. Inflammation and Allergy. V. 8. P. 110.
Penfornis P., Pochampally R. 2011. Isolation and expansion of mesenchymal stem cells/multipotential stromal cells from human bone marrow. Methods Mol Biol. V. 698. P. 11.
Pu C., Liu C., Liang C., YenY.-H., Chen S.-H., Jiang-Shieh Y.-F., Chien C.-L., Chen Y.-C., Chen Y.-L. 2016. Adipose-derived stem cells protect skin flaps against ischemia/reperfusion injury via IL-6 expression. J. Investig. Dermatol. V. 137. P. 1353.
Подписи к рисункам:
Рис. 1. Показатель плотности микрососудистого русла у ЛО и перенесших ишемию крыс. а – Плотность артериального участка микрососудистой сети тонуса, б – плотность всего исследованного участка сосудистой сети. Темная заливка – ЛО крысы; светлая заливка – крысы, перенесшие ишемию; штриховка – крысы, перенесшие ишемию, которым в день операции была проведена внутривенная трансплантация МСКч. По горизонтали –время, прошедшее после ишемии; по вертикали – показатель плотности микрососудистого русла. Звездочками отмечены значимые изменения по сравнению с соответствующими значениями у ЛО животных данной группы (*р < 0.05, ***р < 0.001, критерий Краскела-Уоллиса с последующим попарным сравнением групп согласно критерию Данна).
Рис. 2. Число пиальных артерий, ответивших дилатацией на воздействие ацетилхолина. а – 7 сут. после ишемии, б – 14 сут. после ишемии, в – 21 сут. после ишемии. Темная заливка – ЛО крысы, светлая заливка – крысы, перенесшие ишемию, штриховка – крысы, перенесшие ишемию, которым в день операции была проведена внутривенная трансплантация МСКч. По горизонтали – диаметр сосудов, по вертикали – число сосудов, расширившихся в ответ на воздействие ACh, % от общего числа реакций на ACh в группе. Звездочками отмечены значимые изменения по сравнению с соответствующими значениями у ЛО животных данной группы (*р < 0.05, **р < 0.01, ***р < 0.001, критерий Краскела-Уоллиса с последующим попарным сравнением групп согласно критерию Данна).
Рис. 3. Изменение показателя микроциркуляции головного мозга у ЛО и перенесших ишемию крыс. Темная заливка – ЛО крысы, светлая заливка – крысы, перенесшие ишемию, штриховка – крысы, перенесшие ишемию, которым в день операции была проведена внутривенная трансплантация МСКч. По горизонтали– время, прошедшее после ишемии; по вертикали – показатель перфузии. Звездочками отмечены значимые изменения по сравнению с соответствующими значениями у ЛО животных данной группы (*р < 0.05, ***р < 0.001, критерий Краскела-Уоллиса с последующим попарным сравнением групп согласно критерию Данна).