Сборник тезисов V международной научно-практической конференции «От эмбриона к человеку» (27-28 ноября г. Новосибирск)
Пензенцева Е.А.1, Воробьев Е.В.1, Павлов А.Е.1, Сурвило В.Л.1, Швиндина Ю.А,2
1ООО «Вега» Группа компаний «Алкор Био», Санкт-Петербург
2 ООО «Алкор Био» Группа компаний «Алкор Био», Санкт-Петербург
Мутации гена CFTR нарушают работу кодируемого им белка, что приводит к развитию муковисцидоза (МВ) или других «CFTR- патий» (хронического панкреатита, хронического синусита и др.) Помимо этого, мутации и некоторые полиморфизмы данного гена являются одним из частых генетических факторов нарушения фертильности у мужчин. [1].
На данный момент известно более 1700 мутаций, обуславливающих развитие симптомов «CFTR-патий», которые имеют разную частоту встречаемости и тяжесть клинических проявлений [2]. Тем не менее, только 20-30 мутаций (в зависимости от популяции) имеют частоту более 0,1%, поэтому наиболее часто встречающиеся мутации могут покрывать свыше 83,5% клинических случаев МВ. Таким образом, ДНК-диагностика является очень эффективным методом выявления МВ при неонатальном скрининге, и единственно возможным в пренатальный период, а также для выявления носительства при планировании семьи.
Компания «Алкор Био» разработала тест-систему «Муковисцидоз-БиоЧип», позволяющую единовременного определять 25 наиболее часто встречающихся на территории РФ мутаций, с помощью метода ДНК-микрочипов с использованием методов мультиплексной ПЦР и флюоресцентной детекции в формате микрочипа.
В качестве целевых были выбраны 25 мутаций в гене CFTR, вызывающих МВ с сильным фенотипическим проявлением и имеющих высокую частоту встречаемости в европейской и славянской популяциях [3-10]. Список выявляемых мутаций включает: F508del, Dele2-3, G85E, 621+1G>T, R334W, R347P, R347H, 1078delT, I507del, R1162X, S1196X, 3732delA3821delT, 3849+10kbC>T, W1282X, N1303K, 1677delTA, G542X, G551D, R553X, 1717-1G>A, 2143delT, 2184insA, 2183AA>G, 2789+5G>A. Основными являются мутации F508del (частота 64,7 %) и Dele2-3 (частота 8,8 %), которая характерна преимущественно для славянской популяции. Предлагаемая панель позволит выявлять до 95% всех больных, что значительно превосходит эффективность существующих на данный момент генетических тест-систем, которые обычно включают определение 11 – 14 мутаций.
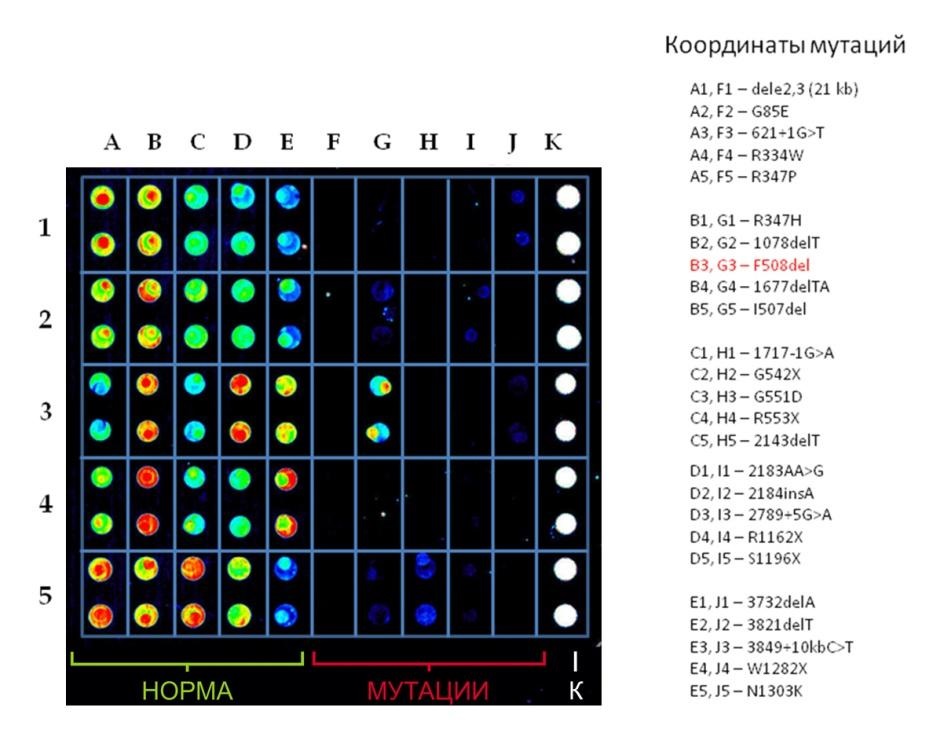
Рисунок 1. Результаты анализа ДНК пациента с генотипом, соответствующим носительству мутации F508del.
В качестве источника геномной ДНК для проведения анализа могут быть использованы - буккальный эпителий, цельная или замороженная кровь, сухие пятна крови, а также образцы хориона и амниоцентеза. Для получения надежных результатов метод выделения должен обеспечивать не менее 10 нг ДНК в концентрации не менее 1 нг/мкл. Подходящим вариантом является метод выделения ДНК на основе спиртового соосаждения, например, набор «Экстра-ДНК-Био» (Алкор Био).
В основе предложенного метода детекции лежит двухстадийная аллель-специфичная ПЦР. Результатом ПЦР является смесь флуоресцентно-меченых зондов, специфичных к исследуемым участкам ДНК. В ходе последующей гибридизации смесь зондов инкубируется с биочипом. Результаты гибридизации детектируются с помощью флуоресцентного сканера. Биочипы из набора «Муковисцидоз-БиоЧип» совместимы со всеми сканерами для чипов стандартного размера 75х25х1 мм. Например, ScanArray Gx (PerkinElmer), MArS (Ditabis), PowerScanner (Tecan),InnoScan (Innopsys).
Для снижения вероятности ошибки поле анализа представлено на биочипе в четырех повторах. Анализ сканированного изображения может быть выполнен как визуально, так и с использованием специального программного обеспечения «Биочип-Мастер». Результатом тестирования является заключение о наличии либо отсутствии мутантных аллелей гена и генотипе пациента (рис. 1).
На данный момент диагностический набор «Муковисцидоз-БиоЧип» прошел технические и клинические испытания и является единственным в РФ набором, имеющим регистрационное удостоверение. Основными характеристики диагностического набора «Муковисцидоз-БиоЧип» являются:
- анализ мутаций специфичных для российской популяции;
- диагностическая чувствительность ~ 80%;
- специфичность ~ 97%;
- аналитическая чувствительность 1 нг/мкл геномной ДНК;
- геномная ДНК может быть получена из различных образцов, в том числе, сухих пятен крови;
- высокая скорость анализа (для анализа 10 образцов на 25 мутаций одним лаборантом требуется около 5 часов);
- не требует дорогостоящего оборудования для гибридизации и нестандартного сканера для детекции результатов;
- удобное программное обеспечение для обработки результатов.
СПИСОК ЛИТЕРАТУРЫ
- Черных В.Б. Ген муковисцидоза и нарушение фертильности у мужчин // Андрология и генитальная хирургия 2010. №4. С. 23-31.
- Консенсунс по муковисцидозу. Медицинская газета, 1995, № 41, 02.06.95.
- Cystic Fibrosis Mutation Database: [www.genet.sickkids.on.ca]. URL: http://www.genet.sickkids.on.ca/cftr/
- Муковисцидоз. Современные достижения и актуальные проблемы. Методические рекомендации. Издание третье (первое 2001) переработанное и дополненное. Под редакцией Капранова Н.И., Каширской Н.Ю. М.: ООО «4ТЕ Арт». 2008. – с.124.
- Castellani C., Cuppens H., Macek M. Jr. et al. Consensus on the use and interpretation of cystic fibrosis mutation analysis in clinical practice. J Cyst Fibr. 2008; 7:179-196.
- Schwarz M., Gardner A., Jenkins L. et al. Testing Guidelines for molecular diagnosis of Cystic Fibrosis. Clin Mol Genet Soc. 2009.
- 32nd European CF Conference, 10-13 June 2009. Brest, France.
- Иващенко Т.Э., Баранов В.С. Биохимические и молекулярно-генетические основы патогенеза муковисцидоза // СПб, Интермедика, 2002, 256 с.
- Dequeker E., Stuhrmann M., Morris MA. et al. Best practice guidelines for molecular genetic diagnosis of cyctic fibrosis and CFTR-related disorders-updated European recommendations. Eur J Hum Genet. 2009; 17:51-65.
- Estivill E., Bancells C., Ramos C. et al. Geographic distribution and regional origin of 272 cystic fibrosis mutations in European populations. Hum Mutat. 1997; 10:135-154.