Справочник заведующего КДЛ №6 июнь 2022 с.17-27
Афанасьева Н.М.1, Калинина Ю.А.1, Кочиш Л.Т.1, Иванова Н.А.2
1 – ООО «Компания Алкор Био»;
2 – ФГБВОУ ВО «Военно-медицинская академия им. Кирова» МО РФ
Введение. Выявление причинно-значимого аллергена часто представляет собой трудновыполнимую задачу для клинического аллерголога-иммунолога. С одной стороны, клинические проявления могут быть не связаны именно с аллергическим воспалением, с другой – могут быть опосредованы не только IgE-зависимым иммунологическим механизмом, что особенно актуально для пищевой аллергии (ПА) или лекарственной гиперчувствительности (ЛГ). Тем не менее, подтверждение или опровержение вовлеченности IgE-опосредованного иммунологического механизма в патогенезе пациента является одним из первых мероприятий в диагностической тактике, наряду со сбором анамнестических данных [1;16].
Среди методов, используемых в современной аллергодиагностике, первостепенное значение имеют in vivo методы тестирования (кожные тесты, скарификационные или прик-кожные тесты). Кожные методы тестирования являются «золотым» стандартом диагностики IgE-зависимых аллергических реакций, особенно в отношении таких групп аллергенов, как бытовые и пыльцевые. Что касается лекарственной гиперчувствительности и пищевой аллергии, согласно актуальным клиническим рекомендациям [1; 2], диагностическая тактика также базируется на использовании кожных и провокационных тестов. Однако, применение in vivo методов имеет ряд ограничений, особенно для ЛГ [2]:
- опасность развития тяжелой системной реакции при проведении теста, что актуально при диагностике как ЛГ, так и ПА;
- наличие стандартизованных аллергенов на ограниченную группу лекарственных средств (в России не зарегистрированы);
- высокая вероятность получения ложноположительных реакций за счет местного раздражающего действия тестируемого препарата (например, для хинолонов и миорелаксантов);
- не учитывается возможность развития ЛГ на метаболиты лекарственного средства;
- провокационные тесты (подъязычный или дозируемый тесты) осуществляются только врачом аллергологом-иммунологом в условиях стационара с отделением реанимации по строгим показаниям при невозможности замены препаратами из других групп.
Трудоемкость, высокий риск жизнеугрожающих состояний и сложность стандартизации провокационных in vivo методов повышают интерес специалистов к лабораторным in vitro тестам (иммунохимическим и функциональным клеточным тестам). Тест активации базофилов (basophil activation test, BAT) являет одним из доступных на сегодняшний день современных методов аллергодиагностики, использующим высокотехнологичный подход к оценке функционального состояния базофилов периферической крови при взаимодействии с аллергеном.
Базофилы, так же, как и тучные клетки, опосредуют патохимическую стадию немедленной аллергической реакции за счет дегрануляции и выброса медиаторов воспаления. Активация и последующая дегрануляция мастоцитов происходит вследствие связывания молекулы аллергена с молекулами специфических IgE-антител, иммобилизованных на высокоафинных рецепторах (FcεRI) на их поверхности. Активация базофилов сопровождается изменением их иммунофенотипа за счет увеличения на поверхности клетки плотности экспрессии маркеров, связанных со слиянием и экзоцитозом гранул (CD203c, CD63 и других) [18; 20]. Таким образом, с помощью базофилов возможно ex vivo смоделировать процесс активации базофилов в ответ на взаимодействие с аллергеном с последующей цитофлуориметрической оценкой. ВАТ может стать альтернативой кожным / провокационным тестам в тех случаях, когда нет возможности провести кожное тестирование, существует риск системной реакции или есть расхождения между анамнезом и результатом in vivo теста или других in vitro тестов (см. Рисунок 1).
Рисунок 1. Место ВАТ в стратегии диагностики аллергических заболеваний
Принцип метода. В ходе кратковременной пробоподготовки цельная кровь пациента с антикоагулянтом проходит этапы инкубации с аллергенами, окрашивания моноклональными антителами и лизиса эритроцитов. Для каждого пациента в обязательном порядке подготавливают как минимум три пробы (в зависимости от количества назначенных аллергенов): отрицательный контроль спонтанной стимуляции (без каких-либо активаторов), положительный контроль стимуляции (неспецифический активатор базофилов) и проба с аллергеном [17]. Подготовленные пробы анализируют на проточном цитофлуориметре.
Стратегия цитометрического анализа в ВАТ заключается в последовательном выборе целевой популяции базофилов с помощью специфичных клеточных маркеров и оценке уровня экспрессии маркера активации. Наиболее распространенными вариантами комбинаций специфичных маркеров для выбора базофилов являются следующие: CD294pos/CD3neg, CCR3pos/CD3neg, CD123pos/HLA-DRneg или IgEpos/CD203pos [13]. Оценка уровня активации осуществляется с помощью маркеров CD203c, который также является линейным маркером базофилов, или CD63. Маркер CD203c, в отличие от CD63, присутствует на поверхности покоящихся базофилов, и его экспрессия возрастает при активации клетки. Для маркера активации CD63 характерен бимодальный профиль экспрессии, т.е. практически полное отсутствие на покоящихся базофилах и значительное возрастание плотности экспрессии на активированных клетках [21; 22; 24]. Особенности экспрессии маркеров активации CD203c и CD63 должны учитываться при оценке результата теста. Так, в первом случае результат будет представлен в виде индекса стимуляции, т.е. отношения интенсивности флуоресценции (MFI) CD203с в пробе с аллергеном к пробе с отрицательным контролем, а во втором – в виде процента CD63pos субпопуляции от общего числа базофилов [13].
Условия клинического применения ВАТ.
ВАТ может иметь различные точки приложения в рутинной клинико-диагностической практике, среди которых можно выделить основные (13; 14; 15):
- Выявление причинно-значимогоаллергена при пищевой, инсектной и лекарственной аллергии (особенно в тех случаях, когда применение стандартного диагностического подхода невозможно) [9; 12; 23]. Кроме того, ВАТ нашел приложение в диагностике таких редких аллергических заболеваний, как острый бронхолегочный аспергиллез (ОБЛА) [3];
- Оценка приемлемости проведения и мониторинг пациентов, находящихся на аллерген-специфической иммунотерапии [26], лечении анти-IgE препаратами (Омализумаб, Omalizumab) [25] или естественного разрешения аллергии. Особенно важна, в данном аспекте, возможность оценить эффективность планируемого лечения и необходимость долгосрочного применения дорогостоящих иммунобиологических препаратов;
- Проведение клинических испытаний, в качестве биомаркера клинического ответа на лечение (как правило, в контексте иммунотерапии). ВАТ позволяет оценить эффективность иммунотерапии по реактивности базофилов и определению минимальной активирующей дозы аллергена, как демонстрацию формирования толерантности иммунной системы к аллергену [26; 27; 28];
- Диагностика аутоиммунной хронической крапивницы [27].
Необходимым условием успешного применения ВАТ в клинической практике является необходимость аналитической и клинической валидации тест-системы, а также клиническая валидация аллергенов для проточной цитометрии. Существующие на данный момент зарегистрированные тест-системы обеспечивают выполнение первого требования, однако проблема стандартизованных аллергенов осталась неразрешенной до настоящего момента и ограничивала широкое внедрение ВАТ в аллергодиагностике.
Актуальные руководства по ВАТ [11; 13; 30; 31] рекомендуют использовать в качестве аллергенов цельные экстракты, например, арахиса [4], куриного яйца, молока [29], пыльцевых аллергенов [6], нативные или рекомбинантные белковые компоненты аллергенов [32;33]. Диагностика лекарственной гиперчувствительности с помощью ВАТ, в соответствии с рекомендациями, может быть проведена с использованием лекарственных препаратов в жидкой форме [5]. Необходимо отметить, что описанный подход требует обязательной стандартизации аллергена на значительной выборке сенсибилизированных и относительно здоровых доноров, что возможно только в условиях научно-исследовательской лаборатории, но может быть неудобным для клинико-диагностических лабораторий. Единственным коммерчески доступным вариантом стандартизованных аллергенов для клеточных тестов на российском рынке являются лиофилизованные аллергены компании Bühlmann (Швейцария). Использование этих реагентов подразумевает постановку одновременно для нескольких (до 4х) человек, т.к. восстановленные аллергены не предназначены для длительного хранения.
Практический подход к валидации тест-системы и аллергенов для ВАТ. Более 10 лет компания Алкор Био занимается производством реагентов для аллергодиагностики, в том числе и большого спектра аллергенов. Накопленный опыт работы позволил развернуть разработку стандартизованных аллергенов для применения в проточной цитометрии. Для проведения клинической валидации аллергенов использовалась тест-система «АллергоФлоу» (производство ООО «Компания Алкор Био»), прошедшая все необходимые этапы верификации и валидации в соответствии актуальными рекомендациями Института Клинических и Лабораторных Стандартов [7; 8].
В наборе «АллергоФлоу» реализован принцип базофильного теста с использованием трехцветной панели моноклональных антител для проведения цитофлуориметрического анализа.
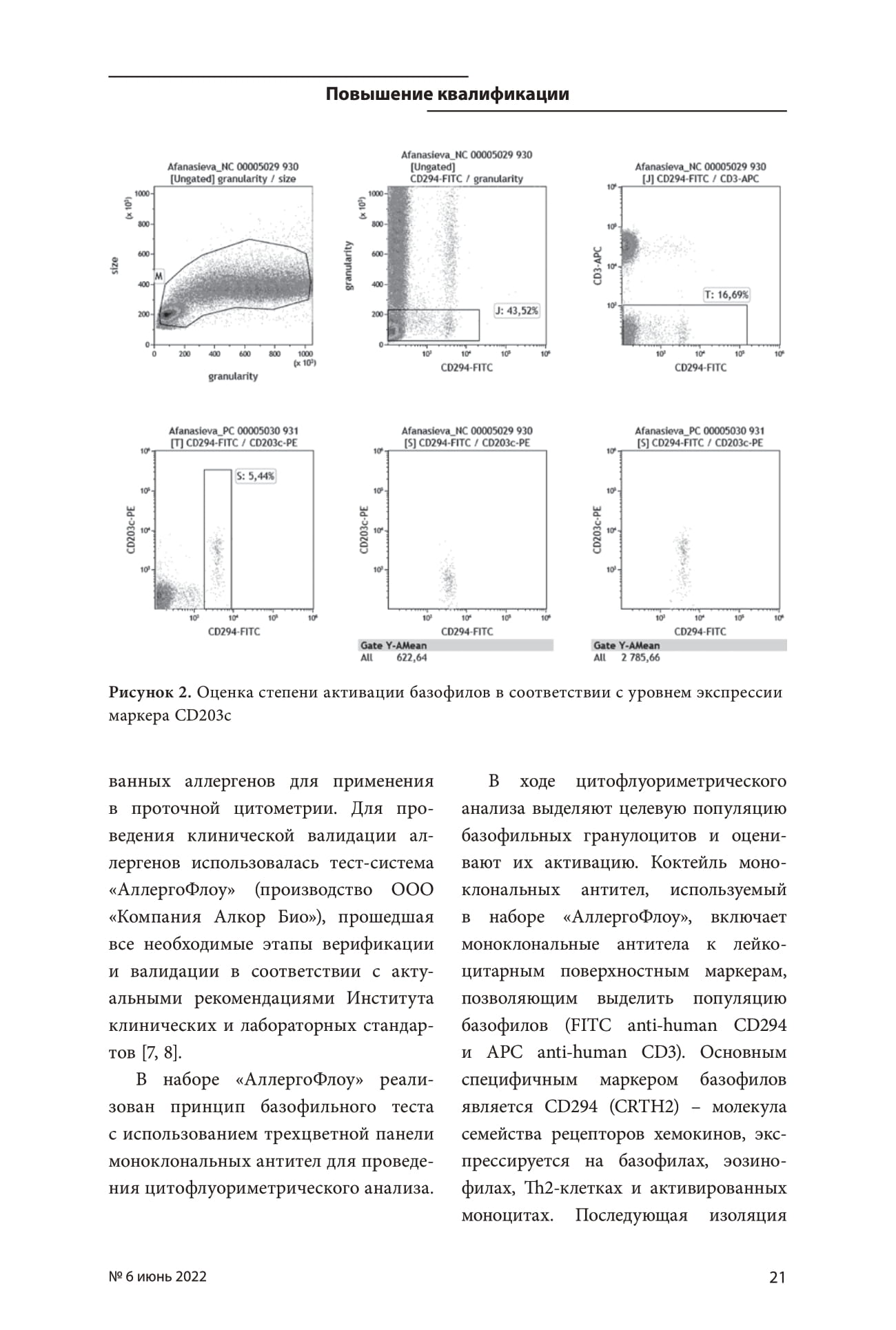
В ходе цитофлуориметрического анализа выделяют целевую популяцию базофильных гранулоцитов и оценивают их активацию. Коктейль моноклональных антител, используемый в наборе «АллергоФлоу», включает моноклональные антитела к лейкоцитарным поверхностным маркерам, позволяющим выделить популяцию базофилов (FITC anti-human CD294 и APC anti-human CD3). Основным специфичным маркером базофилов является CD294 (CRTH2) – молекула семейства рецепторов хемокинов, экспрессируется на базофилах, эозинофилах, Th2-клетках и активированных моноцитах. Последующая изоляция базофилов от эозинофилов осуществляется по параметру бокового светорассеяния SS (см. Рисунок 2, Гистограмму 2) и от Th2-лимфоцитов – с помощью лимфоцитарного маркера CD3 (см. Рисунок 2, Гистограмму 3). Активированные моноциты, в свою очередь, имеют более низкую плотность экспрессии CRTH2 (CD294dim), чем базофилы. Степень активации базофилов оценивается по уровню экспрессии маркера CD203c (см. Рисунок 2, Гистограмму 5а и 5b). Маркер CD203c также является специфичным для базофилов, т.к. присутствует и на неактивированных клетках. Таким образом, фенотип базофилов можно описать как SSlow / CD294bright / CD3neg / CD203c pos.
Рисунок 2.
Результатом исследования является индекс стимуляции (SI), который показывает, во сколько раз уровень экспрессии маркера CD203c в пробе с аллергеном или в пробе с положительным контролем выше, чем в отрицательном контроле.
Корректная интерпретация результатов теста требует включения проб отрицательного (ОК) и положительного контроля (ПК) в панель обследования каждого пациента. В случае отсутствия результатов по ПК или в случае низкого уровня активации в ПК (SI <1,1), отрицательный результат в пробе с аллергеном можно расценивать только как ложноотрицательный, поскольку такой пациент может относиться к группе индивидов, не отвечающих на IgE-опосредованную активацию базофилов, т.н. «non-responders» (приблизительно 5 – 10% индивидов).
Стандартизация аллергенов для ВАТ представляет собой процесс выбора оптимальной рабочей концентрации и определения критериев для интерпретации результата на основании оптимальных значений по специфичности и чувствительности.
- Выбор рабочей концентрации аллергена основан на анализе кривой доза-эффект (dose-response curve), которая отражает зависимость индекса стимуляции базофилов от концентрации аллергена. Форма кривой доза-эффект может быть различной и зависит от сложности структуры и аффинности различных участков антигена (аллергена), эпитопной специфичности локализованных на базофилах IgE молекул [13]. Для корректного выбора рабочей концентрации необходимо проведение анализа на широком диапазоне концентраций аллергенов с привлечением статистически репрезентативной выборки пациентов, поскольку характер кривых может носить индивидуальный характер. Таким образом, оптимальным значением концентрации аллергена является то, при котором возможно получить максимально высокую активацию базофилов (без цитотоксического влияния на лейкоциты) у доноров с подтвержденной сенсибилизацией при минимальной активации у условно-здоровых лиц с учетом значительной индивидуальной вариации.
- Клиническая валидация выбранной рабочей концентрации. Выбор порогового значения SI. Основным аспектом клинической валидации ВАТ является определение порогового значения SI в зависимости от оптимальных значений специфичности и чувствительности для каждого аллергена.
Аналитические характеристики ВАТ зависят от аллергена, используемого для проведения диагностики. Согласно клиническим исследованиям, специфичность ВАТ составляет от 80 % до 100%, а чувствительность варьирует от 46 до 96% [13]. Максимальные значения чувствительности ВАТ демонстрирует для аллергенов белковой природы (аэроаллергены, эпителиальные, пищевые) [11]. Чувствительность ВАТ в диагностике ЛГ значительно ниже (40 – 60%) и очень зависит от ряда преаналитических факторов, таких как, характер и срок давности клинических проявлений. Тем не менее, ВАТ крайне полезен при необходимости уточнить неоднозначные результаты, полученные другими in vitro методами, а также при невозможности проведения провокационных исследований.
Для проведения клинической валидации каждого аллергена, на базе кафедры «Детских болезней» Военно-медицинской академии им.Кирова формировались две выборки: «Группа 1» – пациенты с подтвержденной сенсибилизацией и «Группа 2» – условно-здоровые доноры. Минимальное количество пациентов в группах определялось на основании анализа мощности исследования (d = 0,8, α = 0,05, Actual Power = 0,8) и составило: 15 пациентов в Группе 1 и 20-30 человек для Группы 2.
Формирование групп исследования проводилось на основании критериев включения и исключения. Пациенты включались в группу при наличии анамнеза, результатов, полученных хотя бы одним из методов сравнения: специфические IgE антитела (исследование проводилось в тест-системе «ИФА – специфические IgE» (ООО «Компания АлкорБио», Россия) или скарификационные кожные пробы (проводились в кабинете аллерголога на кафедре «Детских болезней» Военно-медицинской академии им. Кирова). Кроме того, при проведении ВАТ оценивалось значение SI в положительном контроле, которое должно быть не менее 1,1. Те образцы, для которых SI (ПК) было меньше установленного критерия, исключались из анализа, поскольку относились либо к категории «non-responders», либо имели высокий уровень спонтанной активации базофилов (в отрицательном контроле), что также несет риск некорректной интерпретации результата.
Значение порогового SI (Cut-off SI) определялось по формуле:
Cut-off SI = Mean (SI) +2SD
где Mean (SI) – среднее арифметическое значение SI в Группе 2 (условно-здоровые доноры);
SD – стандартное квадратичное отклонение в Группе 2 (условно-здоровые доноры).
Ниже приведена иллюстрация процесса стандартизации аллергена Тимофеевка луговая (как наиболее демонстративный пример), а также оптимальные аналитические характеристики, полученные при выбранном значении Cut-off SI.
Стандартизация аллергенов для проточной цитометрии на примере аллергена Тимофеевка луговая (g6)
1. Выбор рабочей концентрации
Для выбора рабочей концентрации аллергена Тимофеевка луговая были проанализированы результаты ВАТ, проведенного с использованием пяти разведения аллергена. Выборка положительных и отрицательных доноров включала по 10 человек с подтвержденной сенсибилизацией и условно-здоровых (отрицательных) соответственно. Описание групп приведено в Таблице 1.
Таблица 1. Характеристика групп доноров для выбора рабочей концентрации аллергена Тимофеевка луговая, Медиана и межквартильный интервал
|
Группа |
Возраст, лет |
Уровень spIgE (g6), МЕ/мл |
SI(ПК) |
SI (g6) |
|
Положительные доноры (n=10) |
5,5 (5,00 – 9,25) |
3,35 (1,69 – 8,45)* |
3,5 (3,05 – 5,65) |
3,89 (3,15 – 5,45)* |
|
Отрицательные доноры (n =10) |
8,0 (5,0 – 11,5) |
0,21 (0,16 – 0,29)* |
2,1 (1,73 – 4,46) |
1,12 (0,97 – 1,35)* |
* р-value < 0,05
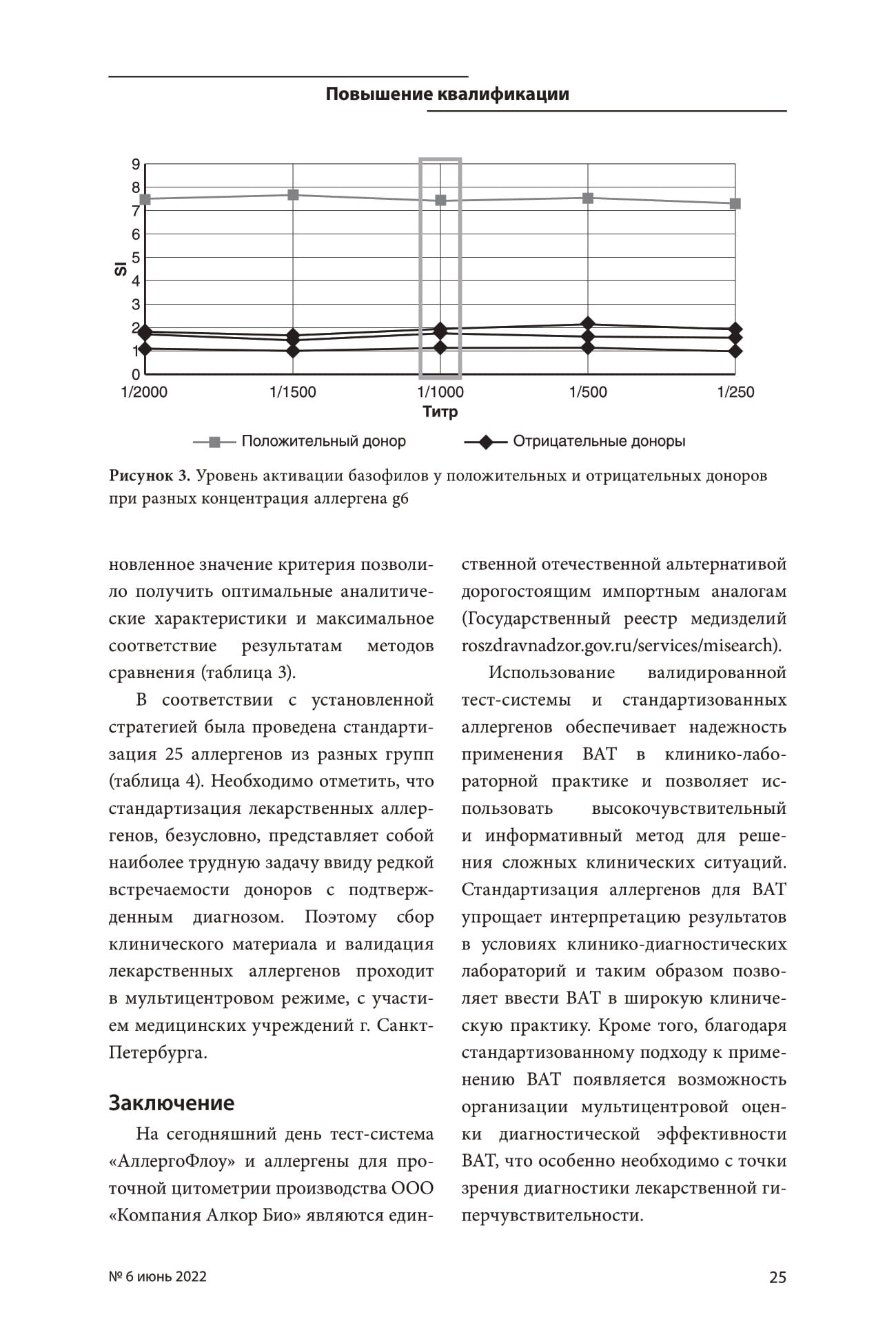
Рисунок 3. Уровень активации базофилов у положительных и отрицательных доноров при разных концентрация аллергена g6.
Для пыльцевых аллергенов наблюдается значительная активация базофилов у сенсибилизированных доноров, уровень которой практически не меняется (КВ% <10%) в зависимости от концентрации аллергена. Значение РК выбиралось на основании отсутствия цитотоксического влияния дозы аллергена на лейкоциты и минимальной активации базофилов у отрицательных доноров.
2. Клиническая валидация и выбор cut-offSI.
Для проведения клинической валидации и выбора порогового значения SI для аллергена Тимофеевка луговая (g6) были собраны две группы доноров. Группа 1 включала пациентов с клиническими проявлениями поллиноза в анамнезе и подтвержденной сенсибилизацией к аллергену Тимофеевка луговая (с помощью результатов ИФА и/или СКП). Для получения достоверных результатов обследование больных данной группы проводилось вне сезона обострения. Группа 2 включала условно-здоровых доноров или доноров с другим спектром сенсибилизации. Характеристика групп исследования и результаты приведены ниже.
Таблица 2. Характеристика групп доноров для проведения клинической валидации аллергена Тимофеевка луговая, Медиана и межквартильный интервал
|
Группа |
Возраст, лет |
Уровень spIgE (g6), МЕ/мл |
Среднее значение (ПК) |
Среднее значение (g6) |
|
Положительные доноры (n=20) |
14,5 ( 10,0 – 16,2) |
4,37 (1,94 – 26,68)* |
3,5 (2,92 – 5,67) |
3,50 (2,92 – 5,67)* |
|
Отрицательные доноры (n = 33) |
11,0 (9,0 – 16,0) |
0,02 (0,00 – 0,21)* |
2,35 (1,73 – 4,5) |
1,12 (0,97 – 1,42)* |
* р-value <0,05
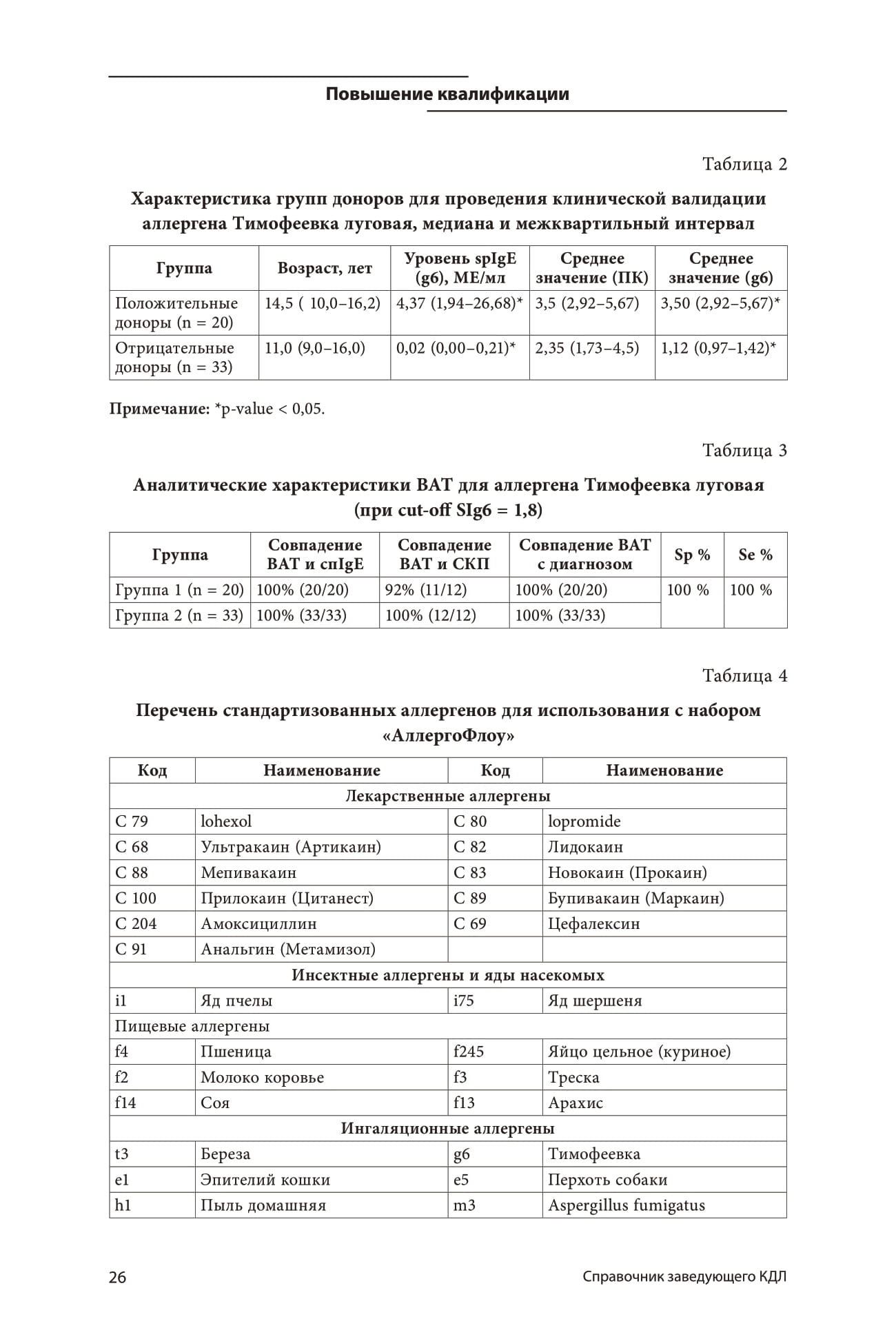
Группы исследования достоверно различались по среднему арифметическому значению SI с аллергеном (p <0,05). На основании результатов ВАТ, полученных в Группе 2, было определено пороговое значение SI для аллергена g6 (cut-off SIg6 = 1,8). Установленное значение критерия позволило получить оптимальные аналитические характеристики и максимальное соответствие результатам методов сравнения (см. Таблицу 3).
Таблица 3. Аналитические характеристики ВАТ для аллергена Тимофеевка луговая (при cut-off SIg6 = 1,8)
|
Группа |
Совпадение ВАТ и спIgE |
Совпадение ВАТ и СКП |
Совпадение ВАТ с диагнозом |
Sp % |
Se % |
|
Группа1 (n=20) |
100% (20 / 20) |
92% (11 / 12) |
100%(20/ 20) |
100 % |
100 % |
|
Группа2 (n=33) |
100% (33/33) |
100% (12 / 12) |
100%(33/33) |
В соответствии с установленной стратегией была проведена стандартизация 25 аллергенов из разных групп (Таблица 4). Необходимо отметить, что стандартизация лекарственных аллергенов, безусловно, представляет собой наиболее трудную задачу ввиду редкой встречаемости доноров с подтвержденным диагнозом. Поэтому сбор клинического материала и валидация лекарственных аллергенов проходит в мультицентровом режиме, с участием медицинских учреждений г. Санкт-Петербурга.
Таблица 4. Перечень стандартизованных аллергенов для использования с набором «АллергоФлоу»
Заключение. На сегодняшний день тест-система «АллергоФлоу» и аллергены для проточной цитометрии производства ООО «Компания Алкор Био» являются единственной отечественной альтернативой дорогостоящим импортным аналогам.
Использование валидированной тест-системы и стандартизованных аллергенов обеспечивает надежность применения ВАТ в клинико-лабораторной практике и позволяет использовать высокочувствительный и информативный метод для решения сложных клинических ситуаций. Стандартизация аллергенов для ВАТ упрощает интерпретацию результатов в условиях клинико-диагностических лабораторий и, таким образом, позволяет ввести ВАТ в широкую клиническую практику. Кроме того, благодаря стандартизованному подходу к применению ВАТ, появляется возможность организации мультицентровой оценки диагностической эффективности ВАТ, что особенно необходимо с точки зрения диагностики лекарственной гиперчувствительности.
Список литературы
- Федеральные клинические рекомендации по диагностике аллергических заболеваний// Клинические рекомендации. Аллергология и клиническая иммунология / Под ред. Хаитова Р.М., ИльинойН.И. М.: ГЭОТАР-Медиа, 2019, с.170-189;
- Федеральные клинические рекомендации по диагностике и лечению лекарственной аллергии // Клинические рекомендации. Аллергология и клиническая иммунология / Под ред. Хаитова Р.М., ИльинойН.И. М.: ГЭОТАР-Медиа, 2019, с.190 – 213;
- Козлова Я.И., Учеваткина А.Е., Бычкова Н.В., Филиппова Л.В., Аак О.В., Пятакова А.В., Фролова Е.В., Давыдова Н.И., Климко Н.Н. Тест активации базофилов в диагностике аллергического бронхолегочного аспергиллеза. Клиническая микология, 2016., Т.18, №3, с.7-11.
- Sabato V Basophil activation reveals divergent patient-specific responses to thermally processed peanuts. J Investig Allergol Clin Immunol. 2011; 21: 527-31.
- Larsen JN, Dreborg S. Standardization of allergen extracts. Methods Mol Biol 2019; 2020, 63-76.
- Khan et al.: Basophil activation test compared to skin prick test and fluorescence enzyme immunoassay for aeroallergenspecific Immunoglobulin-E. Allergy, Asthma & Clinical Immunology 2012
- CLSI H-62 Validation of Assays Performed by Flow Cytometry (2021г.);
- Selliah, N., Eck, S., Green, C., Oldaker, T., Stewart, J., Vitaliti, A., Litwin, V. Flow cytometry method validation protocols. Current Protocols in Cytometry. 2019, 87, e53.
- Santos AF, Douiri A., Bécares N., Wu S.-Y., Stephens A., Radulovic S., Chan S., Fox AT, Toit GD, Turcanu, Lack G. Basophil activation test discriminates between allergy and tolerance in peanut-sensitized children. J Allergy Clin Immunol. 2014; 134(3): 645–652.
- Santos AF, Brough HA. Making the most of in vitro tests to diagnose food allergy. J Allergy Clin Immunol Pract. 2017; 5(2): 237-248.
- Santos AF, Shreffler WG. Road map for the clinical application of the basophil activation test in food Allergy. Clin Exp Allergy 2017; 47(9): 1115-1124.
- Santos AF, Lack G. Basophil activation test: food challenge in a test tube or specialist research tool? Clin Transl Allergy. 2016; 6: 10.
- Santos AF, Alpan O, Hoffmann H. Basophil activation test: Mechanisms and considerations for use in clinical trials and clinical practice. Allergy. 2021;76:2420–2432
- Depince-Berger Basophil bactivation test: implementation and standardization between systems and between instruments. Cytometry A. 2017; 91(3): 261-269.
- Uyttebroek AP. Basophil activation tests: time for a reconsideration. Expert Rev Clin Immunol. 2014; 10(10): 1325-1335.
- Ansotegui I.J., Melioli G., Canonica G.W., Caraballo L., Villa E., Ebisawa M., Passalacqua G., Savi E., Ebo D., Gómez R.M., Luengo Sánchez O., Oppenheimer J.J., Jensen-Jarolim E., Fischer D.A., Haahtela T., Antila M., Bousquet J.J., Cardona V., Chiang W.C., Demoly P.M., DuBuske L.M., Ferrer Puga M., Gerth van Wijk R., González Díaz S.N., Gonzalez-Estrada A., Jares E., Kalpaklioğlu A.F., Kase Tanno L., Kowalski M.L., Ledford D.K., Monge Ortega O.P., Morais Almeida M., Pfaar O., Poulsen L.K., Pawankar R., Renz H.E., Romano A.G., Rosário Filho N.A., Rosenwasser L., Sánchez Borges M.A., Scala E., Senna G.E., Sisul J.C., Tang M.L.K., Thong B.Y., Valenta R., Wood R.A., Zuberbier T. IgE allergy diagnostics and other relevant tests in allergy, a World Allergy Organization position paper. World Allergy Organ J. 2020; 13(2).
- Hoffmann H.J., Santos A.F., Mayorga C., Nopp A., Eberlein B., Ferrer M., Rouzaire P., Ebo D.G., Sabato V., Sanz M.L., Pecaric-Petkovic T., Patil S.U., Hausmann O.V., Shreffler W.G., Korosec P., Knol E.F. The clinical utility of basophil activation testing in diagnosis and monitoring of allergic disease. Allergy, 2015;70(11):1393- 1405.
- Karasuyama H., Tsujimura Y., Obata K., Mukai K. Role for basophils in systemic anaphylaxis. Chem. Immunol. Allergy, 2010; 95: 85-97.
- Kim Z., Choi B.S., Kim J.K., Won D.I. Basophil markers for identification and activation in the indirect basophil activation test by flow cytometry for diagnosis of autoimmune urticaria. Ann. Lab. Med., 2016; 36(1): 28-35.
- Chirumbolo S., Vella A., Ortolani R., De Gironcoli M., Solero P., Tridente G., Bellavite P. Differential response of human basophil activation markers: a multi-parameter flow cytometry approach. Clin. Mol. Allergy. 2008; 6: 12.
- Ebo DG., Bridts CH., Hagendorens MM., Aerts NE., De Clerck LS., Stevens WJ. Basophil activation test by flow cytometry: Present and future applications in allergology. Cytometry Part B. 2008; 74B: 201–210.
- Ocmant A., Peignois Y., Mulier S., Hanssens L., Michils A., Schandene L. Flow cytometry for basophil activation markers: The measurement of CD203c up-regulation is as reliable as CD63 expression in the diagnosis of cat allergy. Journal of Immunological Methods. 2007; 320: 40–48
- Nucera, E.; Inchingolo, R.; Nicotra, R.; Ferraironi, M.; Ricci, A.G.; Parrinello, G.; La Sorda, M.; Sanguinetti, M.; Gasbarrini, A.; Rizzi,A. et al. Influence of Antihistamines on Basophil Activation Test in Food Allergy to Milk and Egg. Diagnostics. 2021; 11: 44.
- MacGlashan. DW. Basophil activation testing. J Allergy Clin Immunol. 2013; 132: 777-87.
- Johansson SG, Nopp A, Oman H, et al. The size of the disease relevant IgE antibody fraction in relation to ‘total-IgE’ predicts the efficacy of anti-IgE (Xolair) treatment. Allergy. 2009;64(10):1472-1477.
- Schmid JM, Wurtzen PA, Dahl R, Hoffmann HJ. Early improvement in basophil sensitivity predicts symptom relief with grass pollen immunotherapy. J Allergy Clin Immunol. 2014; 134(3): 741-744.
- Saini SS. Basophil Responsiveness in Chronic Urticaria. Curr Allergy Asthma Rep. 2009; 9(4): 286–290.
- Eckman JA, Sterba PM, Kelly D. et al. Effects of omalizumab on basophil and mast cell response using an intranasal cat allergen challenge. J Allergy Clin Immunol. 2010; 125(4); 889-895.
- Sato S., Tachimoto H., Shukuya A., Kurosaka N., Yanagida N., Utsunomiya T. Basophil Activation Marker CD203c Is Useful in the Diagnosis of Hen’s Egg and Cow’s Milk Allergies in Children. Int Arch Allergy Immunol. 2010;152(1): 54–61.
- Ebo DG., Bridts CH., Mertens CH., Sabato V. Principles, potential, and limitations of ex vivo basophil activation by flow cytometry in allergology: A narrative review. J Allergy Clin Immunol. 2021 Apr;147(4):1143-1153.
- Bridts CH., Mertens CH., Sabato V, Hagendorens MM., De Clerck LS. , Ebo DG. Flow Cytometric Allergy Diagnosis: Basophil Activation Techniques. Basophils and Mast Cells: Methods and Protocols, Methods in Molecular Biology. 2014; 1192 (11): 147-159.
- Tokuda R., Nagao M., Hiraguchi Y., Hosoki K. et al. Antigen-Induced Expression of CD203c on Basophils Predicts IgE-mediated Wheat Allergy. Allergology International. 2009; 58:193-199.
- Song Y., Wang J., Leung N., Wang LX., Lisann L. et al. Correlations between basophil activation, allergen-specific IgE with outcome and severity of oral food challenges. Ann Allergy Asthma Immunol. 2015; 114: 319-326.




 |
|
 |
|
 |
|
 |
|
 |