ЦИТОЛОГИЯ
2022 год, том 64, № 1, стрю 47-57
Оригинальная статья
УДК 576.3/.53/.7
ВЛИЯНИЕ ВНУТРИВЕННОЙ ТРАНСПЛАНТАЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ КЛЕТОК НА ФУНКЦИОНАЛЬНУЮ АКТИВНОСТЬ КАТФ-КАНАЛОВ ПИАЛЬНЫХ АРТЕРИЙ ПОСЛЕ ИШЕМИИ/РЕПЕРФУЗИИ ГОЛОВНОГО МОЗГА
И. Б. Соколова1, *, О. П.Горшкова1, Н. Н. Павличенко2
1Институт физиологии имени И.П. Павлова РАН,
Санкт-Петербург,199034 Россия
2ООО «Транс-Технологии», Санкт-Петербург, 192148, Россия
*Email: SokolovaIB@infran.ru
Цель: исследование влияния внутривенной трансплантация мезенхимных стволовых клеток человека (МСКч) на функциональное состояние Катф-каналов гладкомышечных клеток церебральных артерий на разных сроках постишемического периода.
С помощью установки для прижизненной визуализации пиальных сосудов исследовали реакцию артерий на воздействие блокатора Катф-каналов глибенкламида (GB), активатора этих же каналов пинацидила (PI), ацетилхолина (ACh), и AСh на фоне действия GB (ACh/GB) через 7, 14, 21 сут. после ишемии/реперфузии (И/Р) головного мозга и внутривенной трансплантации МСКч. На воздействие GB через 7 сут. после И/Р сузилось в 2 – 5 раз меньше артерий, чем в ЛО группе, а на действие PI расширилось в 1,5 раза меньше. Введение МСКч в день проведения И/Р головного мозга через 7 сут. никак не отразилось на функционировании Катф-каналов: констрикторная реакция на GB и дилататорная на PI в этой группе была такой же, как и у животных, перенесших И/Р. Через 14 сут. после И/Р число сузившихся на GB пиальных артерий было в 1,5 – 2 раза меньше, чем у ЛО крыс; число артерий, ответивших дилатацией на PI, было меньше в 2 – 2,5 раза. В группе клеточной терапии на 14 сут. после И/Р число сузившихся пиальных артерий под воздействием GB и расширившихся под воздействием PI практически полностью соответствовало таковым у ЛО крыс. На 21 сут. после И/Р наблюдали полное восстановление реакций пиальных артерий на GB до уровня ЛО крыс. В группе клеточной терапии реактивность пиальных артерий полностью соответствовала показателям в группе ЛО животных. О функциональном состоянии Катф-каналов после И/Р головного мозга судили сопоставляя дилататорные реакции пиальных артерий при воздействии чистым ACh и AСh на фоне блокировки Катф-каналов с помощью глибенкламида (ACh/GB). У ЛО животных GB блокировал дилататорную реакцию на AСh. Применение AСh на фоне GB привело к росту числа дилатаций через 7 – 14 сут. после И/Р, а через 21 сут. число расширившихся сосудов на воздействие AСh и ACh/GB было одинаковым. После введения МСКч, исключая первые 7 сут., GB блокировал дилататорную реакцию пиальных артерий на AСh также, как в ЛО группе.
Заключение: И/Р коры головного мозга крыс снижает вклад Катф –каналов в поддержание базального тонуса пиальных артериальных сосудов. Изменения сохраняются на протяжении 14 сут. после ишемического воздействия. Одновременно с этим в период с 7 по 21 сут. после И/Р снижается роль Катф –каналов в дилатации пиальных артерий на AСh: к 21 сут. каналы практически не участвуют в дилататорном ответе. Внутривенная трансплантация МСКч в день проведения И/Р головного мозга приводит к более раннему (уже через 14 сут.) восстановлению участия Катф-каналов ГМК в поддержании базального тонуса и осуществлении AСh-опосредованной дилатации пиальных артерий.
Ключевые слова: ишемия/реперфузия, головной мозг, пиальные артерии, внутривенная трансплантация, мезенхимные стволовые клетки, Катф-каналы
Принятые сокращения: АД – артериальное давление, ГМК - гладкомышечные клетки, И/Р – ишемия/реперфузия, ЛО – ложнооперированные крысы, МСК и МСКч – мезенхимные стволовые клетки и МСК человека соответственно, AСh – ацетилхолин, AСh/ GB – действие ацетилхолина на фоне пинацидила, GB – глибенкламид, PI – пинацидил.
Ишемия/реперфузия (И/Р) головного мозга приводит к повреждению мозговой ткани. Морфологические изменения нарастают с течением времени. Первые признаки апоптоза выявляются уже через 6 часов после воздействия. Через 7 сут. начинается некроз нейронов. В это же время наблюдается и изменения в мозговом сосудистом русле: дистония сосудистых стенок, периваскулярные отеки и мелкие периваскулярные кровоизлияния (Шертаев М. М. и др.). Нарушения, происходящие в церебральном сосудистом русле, во многом предопределяют исход И/Р. Важнейшими элементами, обеспечивающими нормальное функционирование сосудистой сети, являются ионные каналы. Значительную роль в регуляции тонуса мозговых сосудов играют АТФ-чувствительные калиевые каналы (КАТФ) (Syed et al., 2019). Катф-каналы гладкомышечных клеток (ГМК) мозговых артерий – октомеры, состоящие из 4 Kir6.2 субъединиц, образующих проводящую пору в клеточной мембране и 4-х дополнительных белков – рецепторов к сульфонилмочевине SUR2B, которые отвечают за фармакологические свойства каналов. Активация Катф-каналов приводит к уменьшению активности потенциал-зависимых кальциевых каналов, снижению внутриклеточной концентрации Ca2+, гиперполяризации клеточной мембраны, расслаблению ГМК и увеличению диаметра артерий. Напротив, ингибирование Катф-каналов сопровождается входом Ca2+ в ГМК через кальциевые каналы, высвобождению Ca2+ из внутриклеточных депо, деполяризации мембраны ГМК, уменьшению диаметра артерий и увеличению сосудистого сопротивления (Гусакова С. В. и др. 2017). КАТФ – каналы чувствительны к различного рода гипоксическим состояниям (Yang … Foster). Процессы И/Р могут вызвать нарушение функционирования этих каналов и, как следствие, ухудшение дилататорной реакции церебральных сосудов. Локальное сужение или закрытие мозговых артерий приводят к развитию повторной очаговой ишемии, усугубляющей повреждение ткани головного мозга.
Для коррекции ишемических состояний и предотвращения постишемической гибели нейронов необходима разработка методов восстановления структуры и функциональности сосудистого русла. В многочисленных работах показано, что трансплантация МСК после ишемических или травматических повреждений головного мозга приводит к уменьшению объема поврежденной ткани, сохранению функции нейронов в пограничной с повреждением зоне, восстановлению микроциркуляции (Ball et al., 2007; Yang et al., 2015; Sheikh et al., 2019). Применение МСК для восстановления функциональной активности ионных каналов – практически не исследованный путь коррекции постишемических осложнений.
Цель данной работы - исследование влияния внутривенной трансплантация мезенхимных стволовых клеток человека (МСКч) на функциональное состояние Катф-каналов гладкомышечных клеток церебральных артерий на разных сроках постишемического периода. В задачи исследования входило: 1 - изучение изменения вклада КАТФ – каналов в поддержание базального тонуса и осуществление опосредованной ацетилхолином (ACh) дилатации пиальных артериальных сосудов у крыс через 7, 14 и 21 сут. после кратковременной глобальной транзиторной И/Р коры головного мозга; 2- исследование влияния внутривенного введения (МСКч), проведенного в день И/Р головного мозга, на постишемическое изменение вклада КАТФ – каналов в дилатацию пиальных артерий на ACh у крыс через 7, 14 и 21 сут. после И/Р.
МАТЕРИАЛЫ И МЕТОДЫ
Работа проведена на животных из биоколлекции «Коллекция лабораторных млекопитающих разной таксономической принадлежности» Института физиологии им. И.П. Павлова РАН, поддержанной программой биоресурсных коллекций ФАНО России. Исследования проводили в соответствии с регламентом, установленным МЗСР РФ № 708н от 23.08.10 («Правила лабораторной практики»), Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях, и рекомендациями биоэтической комиссии Института физиологии им. И.П. Павлова РАН.
Животные. Эксперименты проведены на крысах-самцах Wistar (n = 85). Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище.
Ишемия/реперфузия. У наркотизированных хлоралгидратом (внутрибрюшинно, 43 мг/100 г массы тела) крыс ишемию воспроизводили с использованием техники 12-минутной окклюзии обеих сонных артерий с одновременной управляемой гипотензией (снижение и строгое поддержание артериального давления (АД) на уровне 45 ± 2 мм рт. ст. путем забора/реинфузии крови в гепаринизированный шприц). Прямое измерение АД производили через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур), подключенным к компьютеру, работающему с оригинальной программой визуализации значений АД, разработанной в нашей лаборатории. По окончании периода ишемии производили полную реинфузию забранной крови. После ушивания операционных ран и выхода из наркоза (на подогреваемых грелках) животных возвращали в клетки обычного содержания.
МСКч и их трансплантация. Для внутривенной трансплантации использовали мезенхимные стволовые клетки человека (МСКч), полученные от одного донора. Выделение МСК из костного мозга, их культивирование и фенотипирование проводили в ООО «Транс-Технологии» по стандартным, общепринятым методикам (Azizi et al., 1998; Penfornis, Pochampally. 2011). В частности, для культивирования МСКч использовали питательную среду α-МЕМ (Hyclone, Новая Зеландия), с добавлением 20% сыворотки крови эмбрионов коров (Gibco, США) и 100 мкг/мл пенициллина/стрептомицина (Hyclone, Новая Зеландия). Фенотипирование МСКч проводили методом проточной цитофлуориметрии на проточном цитофлуориметре FACSscan (Beckton Dickinson, США). МСКч окрашивали с помощью антител против позитивных маркеров CD90, CD105, CD44, CD73 и антител против негативных маркеров CD45, CD34, CD14, CD11b, HLA-DR и 7AAD (Beckton Dickinson, США). Для трансплантации использовали МСКч на 2—3 пассажах. Внутривенная трансплантация была проведена крысам через 1 час после И/Р головного мозга. Каждому животному было введено 5 млн МСКч в 30 мкл культуральной среды.
Все последующие экспериментальные действия были проведены на наркотизированных (золетил, 20 мг/кг, внутрибрюшинно, Virbac, Франция) крысах; эвтаназия проведена путем введения увеличенной дозы золетила (60 мг/кг).
Группы животных. 1. Контрольная группа: ложнооперированные (ЛО) крысы Вистар, которые подвергались оперативному вмешательству, но без проведения И/Р. Исследования реактивности пиальных артерий у данной и всех последующих групп были проведены на отдельных подгруппах животных через 7, 14, 21 сут. после хирургического воздействия (острые опыты). Вес крыс и АД на 7 сут. (n = 9) составляли 245±13,8 г и 139±5,6 мм рт. ст. соответственно, на 14 сут. (n = 10) - 303±12,7 г и 133±4,6 мм рт. ст. соответственно, на 21сут. (n = 9) - 330±12,2 г и 135±2 мм рт. ст. соответственно.
2. Крысы Вистар, которым была проведена И/Р головного мозга. Вес и АД на 7 сут. (n = 9) составляли 259±12,1 г и 149±4,7 мм рт. ст. соответственно, на 14 сут (n = 8) - 256±5,2 г и 133±5,3 мм рт. ст. соответственно и на 21 сут. (n = 9) - 318±4,2 г и 124±3,9 мм рт. ст. соответственно.
3. Крысы Вистар, которым была проведена И/Р головного мозга и внутривенно введены МСКч. Вес и АД на 7 сут. (n = 9) составляли 250±11,3 г и 144±4,1 мм рт. ст. соответственно, на 14 сут (n = 10) - 306±9,9 г и 134±4,9 мм рт. ст. соответственно и на 21 сут. (n = 12) - 327±6,3 г и 123±5,7 мм рт. ст. соответственно.
Визуализация и мониторинг микрососудистой сети. Для проведения прижизненного исследования реакций пиальных артерий в теменной области черепа животного высверливали отверстие (S ≈ 1 см2). Твердую мозговую оболочку в пределах отверстия удаляли, тем самым открывая поле для дальнейшего исследования. Поверхность мозга непрерывно орошали раствором Кребса (в мМ: NaCl 120.4; KCl 5.9; NaHCО3 15.5; MgCl2 1.2; CaCl2 2.5; NaH2PO4 1.2; глюкоза 11.5; pH 7.4), аэрированного карбогеном. Раствор для орошения, как и все другие применяемые растворы, в течение всего эксперимента содержался в медицинском водяном термостате (TW-2, SIA “ELMI”, Латвия) при температуре +37°C. На протяжении всего эксперимента контролировали среднее АД, показатели которого в течение всего эксперимента оставались примерно на одном уровне для каждой группы животных. Температуру тела животных в течение всего опыта поддерживали на уровне 38оC. Визуализацию пиальных артерий проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM («Микромед», Россия), цветную камеру – видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер. На статических изображениях с помощью компьютерной программы для цитофотометрии «Photo M» (авторская разработка А. Черниговского, http://www.t_lambda.chat.ru) измеряли диаметры пиальных артериальных сосудов. В ходе эксперимента у каждого животного было исследовано более 40 пиальных артерий. Все исследованные пиальные артерии были разбиты на группы: 40 - 60 мкм, 20 - 40 мкм, менее 20 мкм. Исследования реактивности сосудов были проведены через 7, 14 и 21 сут. после И/Р головного мозга (см. раздел «группы животных»). Диаметр артерий фиксировали в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса и при орошении мозга раствором ацетилхолина (AСh) (10-7М/л) (Sigma-Aldrich, USA), блокатором КАТФ-каналов раствором глибенкламида (Glybenclamide, Sigma-Aldrich, 10 мкМ), в растворе диметилсульфоксида (DMSO, Sigma-Aldrich, USA), активатором КАТФ-каналов раствором пинацидила (Pinacidil monohydrate, SigmaAldrich, 200 мкМ, в растворе DMSO). Концентрация DMSO в применяемом растворе глибенкламида (GB) и пинацидила (PI) не превышала 0,1%. Ранее проведенные исследования показали, что DMSO в такой концентрации не оказывает влияние на тонус церебральных артерий (Soltani et al., 2016). Исследование реакции сосудов на воздействие AСh проводили в отсутствии и на фоне блокады КАТФ–каналов (предварительное орошение поверхности мозга раствором GB в течение 10 минут с последующим добавлением AСh в раствор блокатора. Фоновую реакцию на воздействие AСh в каждой группе анализировали по всему массиву сосудов и принимали за 100%. Проверка по критерию Краскела-Уоллеса показала отсутствие значимых различий между отдельными животными в фоновых реакциях на воздействие AСh внутри каждой из исследованных групп. Относительно этого уровня фиксировали изменение диаметра пиальных артерий при воздействии AСh на фоне блокатора КАТФ-каналов GB.
Статистическая оценка данных. Математическая обработка полученных данных проведена с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 («GraphPad Software Inc.», США). Данные представлены в виде среднего арифметического значения и его ошибки. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) рассчитывали при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. При распределении вариант в выборке, при распределении отличном от нормального, при сравнении групп применяли критерий Краскела-Уоллиса с последующим попарным сравнением групп согласно критерию Данна.
Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ
Анализ культуры МСКч методом проточной цитофлуориметрии показал, что она состояла на 99.7% из CD90+, CD73+, CD105+, CD44+-клеток (собственно МСК), на 0.3% CD45+, CD34+- клеток (клетки гемопоэтического ряда) и на 0.5% из CD14+, CD11b+, HLA-DR+. 7AAD+-клеток (нежизнеспособных) было не более 0.9—1%.
|
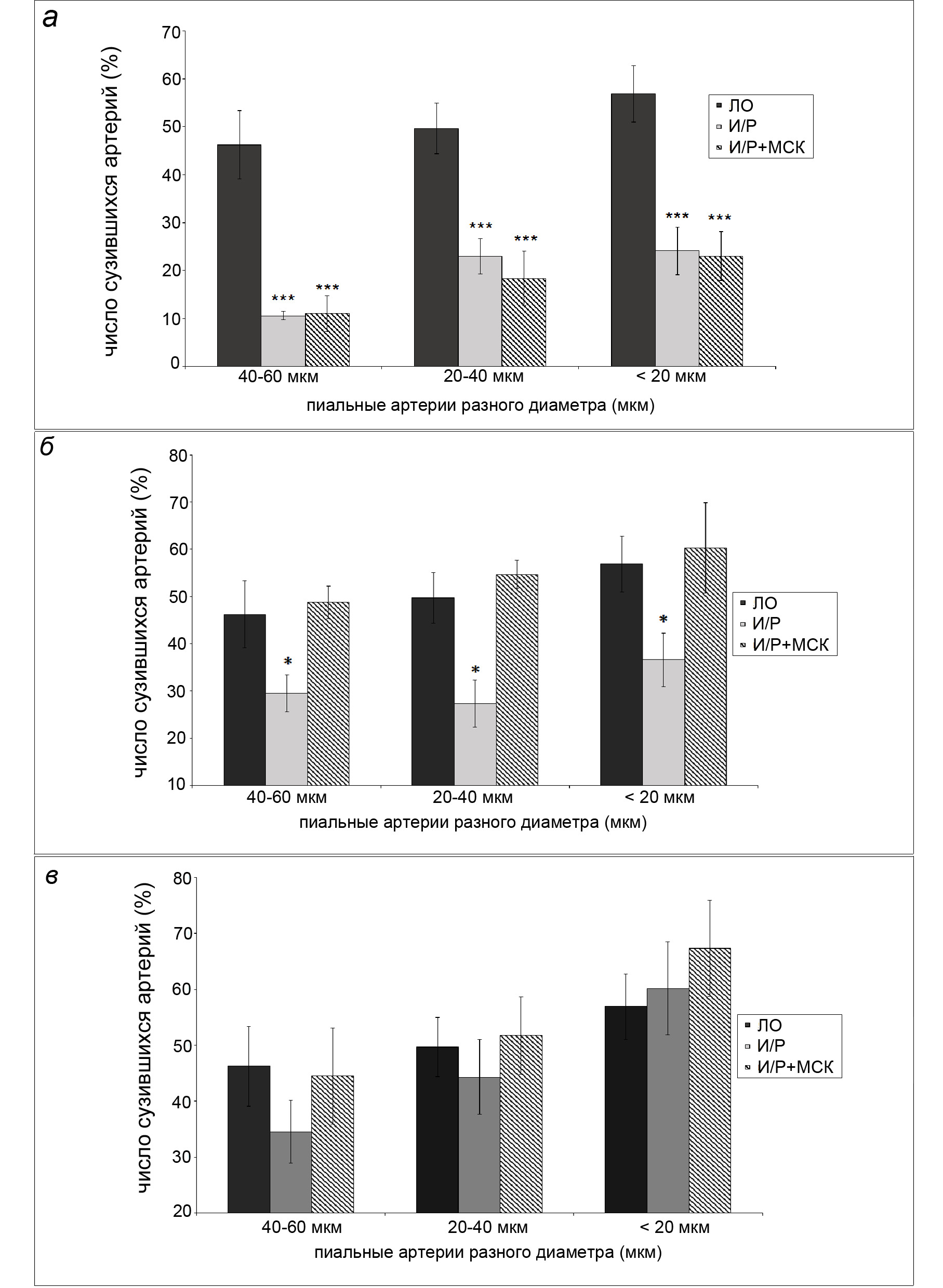
Констрикторная реакция пиальных артерий разного диаметра на воздействие глибенкламидом (GB) представлена на рисунке 1. У ЛО животных на действие GB уменьшением диаметра ответило 46 – 57 % пиальных артерий. В этой группе не было выявлено статистически значимой разницы в реактивности пиальных артерий внутри одного калибра (40-60 мкм, 20-40 мкм, менее 20 мкм) на разных сроках послеоперационного периода, поэтому для сравнения с другими экспериментальными группами представлены усредненные данные по всем результатам в течение эксперимента с 7 до 21 сут.
Через 7 сут. после И/Р головного мозга констрикторная реакция пиальных артерий на воздействие GB была выражена гораздо слабее, чем у ЛО крыс: уменьшением диаметра ответило 10 – 24% исследованных артерий. Такой же результат был получен и для группы клеточной терапии (рис. 1А).
Через 14 сут. после И/Р на воздействие GB сужением ответило 27-40% пиальных артерий. В группе клеточной терапии – 50-60% (рис. 1Б).
Через 21 сутки после И/Р после применения GB диаметр уменьшили 35-60% пиальных артерий; в группе клеточной терапии – 45-67% (рис. 1В).
|
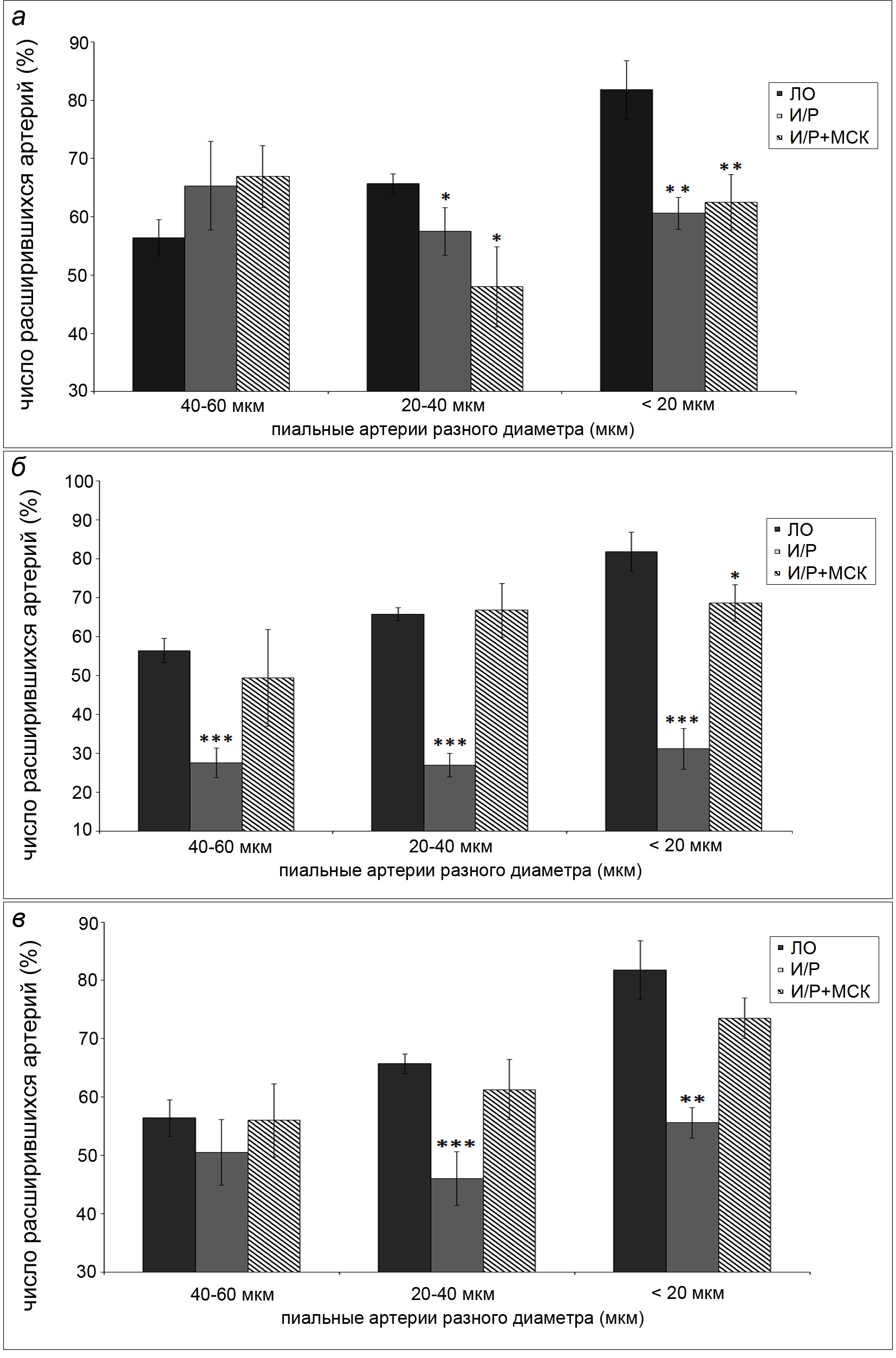
Дилататорная реакция пиальных артерий разного диаметра на воздействие пинацидилом (PI) представлена на рисунке 2. У ЛО крыс на данное воздействие расширением ответило 56 – 82% пиальных артерий. Выявлена статистически значимая зависимость дилататорной реакции от исходного диаметра сосудов: чем мельче артерии, тем больше они расширяются под воздействием PI.
Через 7 сут. после И/Р головного мозга на воздействие PI расширением ответило 57-65% пиальных артерий. Примерно такой же результат был получен и в группе клеточной терапии (48-67%) (рис. 2А). На данном сроке статистически значимая разница в дилататорной реакции между ЛО и другими экспериментальными группами животных имела место у артерий диаметром менее 40 мкм.
Через 14 сут. после И/Р головного мозга дилатация на PI выявлена у 27-31% пиальных артерий, что примерно в 2 раза меньше, чем в ЛО группе, причем на сосудах всех диаметров. В группе клеточной терапии в ответ на аппликацию PI расширилось 49-69% пиальных артерий. Для сосудов диаметром более 20 мкм нет статистически значимой разницы с группой ЛО животных. Для артерий диаметром менее 20 мкм эта разница составила примерно 1,2 раза (рис. 2Б).
Через 21 сут. после И/Р на воздействие PI расширилось 46-56% пиальных артерий. У сосудов диаметром 40-60 мкм не было статистически значимой разницы с ЛО группой, а в более мелких сосудах расширением на PI ответило в среднем в 1,4 раза меньше артерий, чем у ЛО животных (рис. 2В). В группе клеточной терапии увеличение диаметра на PI было отмечено у 56-73% пиальных артерий, что статистически значимо не отличается от результатов, полученных в ЛО группе.
|
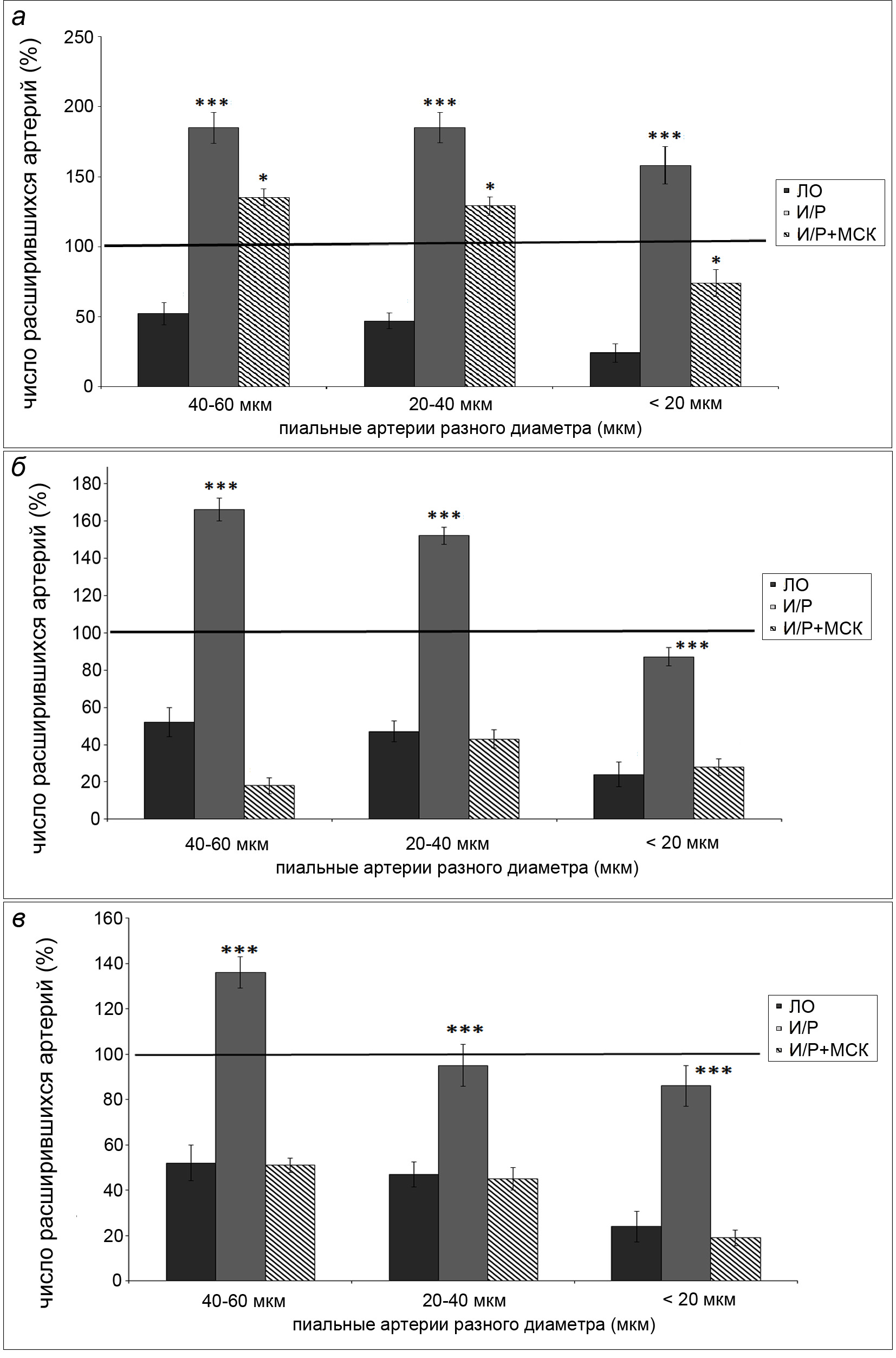
Функциональную активность Катф-каналов пиальных артерий оценивали сравнением числа дилаторных реакций на воздействие ACh и AСh на фоне GB (ACh/GB) (рис.3). У ЛО животных GB подавлял дилататорную реакцию на ACh: на действие ACh/GB расширением ответило в 1,9, 2,1, 4,1 раза меньше пиальных артерий диаметром 40 – 60 мкм, 20 – 40 мкм, менее 20 мкм соответственно. Дилататорная реакция как на чистый ACh, так и на ACh/GB имеет выраженную зависимость от исходного диаметра сосудов: чем мельче артерии, тем больше они расширяются при воздействии ACh и меньше при воздействии ACh/GB.
Через 7 сут. после И/Р головного мозга число расширившихся пиальных артерий при воздействии ACh/GB превышало таковое при действии ACh. В группе клеточной терапии крупные артерии прореагировали на ACh и ACh/GB аналогичным образом. У пиальных артерий диаметром менее 20 мкм выявили незначительное уменьшение числа дилатаций при действии ACh/GB по сравнению с ACh (рис. 3А).
Через 14 сут. после И/Р головного мозга число расширившихся пиальных артерий с исходным диаметром более 20 мкм на воздействие ACh/GB было больше, чем на ACh, а у мельчайших артерий примерно одинаковым. В группе клеточной терапии наблюдали значительное уменьшение числа дилатаций у пиальных артерий всех диаметров при воздействии ACh/GB по сравнению с ACh (рис. 3Б). Этот результат сопоставим с реакциями в группе ЛО крыс.
Через 21 сут. после И/Р число расширившихся пиальных артерий на воздействие ACh и ACh/GB было примерно одинаковым у сосудов диаметром менее 40 мкм. У более крупных сосудов дилататорная реакция на ACh/GB превосходила расширение на ACh. В группе клеточной терапии наблюдали выраженное снижение числа дилатаций при воздействии ACh/GB по сравнению с ACh. В этом случае, как и в группе ЛО животных, дилататорная реакция имела зависимость от начального диаметра сосудов: чем мельче артерии, тем больше было расширение на действие ACh и меньше на воздействие ACh/GB (рис.3 В).
ОБСУЖДЕНИЕ
Клеточная терапия ишемических повреждений головного мозга с применением МСК имеет большой лечебный потенциал. Основное направление применения МСК – сохранение/восстановление структуры и функциональности сосудистого русла. Без адекватного кровоснабжения невозможно предотвратить развитие отдаленных патологических последствий ухудшения мозгового кровотока. К настоящему времени показано, что МСК активируют образование новых сосудов и принимают участие в их стабилизации (Zhou et al., 2012). Представлены данные о дифференцировке МСК в эндотелиальные клетки и ГМК (Oswald et al., 2004, Gong et al., 2008). Экспериментально доказано, что МСК, введенные внутривенно через 24 часа после окклюзии средней мозговой артерии мигрировали в поврежденную мозговую ткань и были выявлены в стенках церебральных сосудах пенумбры (Sheikh et al., 2019). В этой же тканевой зоне наблюдали повышение уровня фактора роста эндотелия сосудов (VEGF) и фактора, индуцируемого гипоксией (HIF-1α). МСК секретируют факторы, способствующие неоваскуляризации ткани: фактор роста фибробластов 2 (FGF-2), VEGF, трансформирующий ростовой фактор (TGFβ), интерлейкины IL-6, IL-8, ангиогенин, фактор роста гепатоцитов (HGF), тромбоцитарный фактор роста (PDGF BB) (Watt et al., 2013). Помимо активации ангиогенеза, МСК могут оказывать протекторное воздействие на клетки церебральных сосудов после ишемического инсульта (Chung et al., 2015; Liu et al., 2019).
Ранее мы показали, что внутривенное введение МСКч в день И/Р головного мозга приводило к сохранению структуры сосудистой сети пиальной оболочки сенсомоторной коры и предотвращало развитие эндотелиальной дисфункции церебральных артерий (Соколова и др., 2021). Для того, чтобы рассматривать клеточную терапию в качестве лечебного мероприятия необходимо выяснить на какие именно механизмы вазодилатации после И/Р головного мозга воздействуют МСК. Один из основных каскадов эндотелий-зависимой вазодилатации: NO (оксид азота)- cGMP (циклический гуанозин монофосфат) - протеинкиназа G (PKG). PKG вызывает расслабление ГМК через несколько механизмов, приводящих к снижению внутриклеточной концентрации Ca2+. cGMP активирует кальций-активируемые калиевые каналы и Катф- каналы, что приводит к гиперполяризации ГМК, их расслаблению и дилатации артерий (Дзугкоев и др. 2010 ). Преобладание констрикторной реакции на ACh, которую мы наблюдали у крыс, перенесших И/Р, на 7, 14 и 21 сут. после операции (Соколова и др., 2021), может быть вызвано повреждением как эндотелиальных клеток, так и ГМК, в частности структуры и функции Катф- каналов. С помощью селективного блокатора Катф- каналов глибенкламида (GB) мы показали, что на 7 сут. после И/Р головного мозга значительно (в 2-5 раз) снижалось число сузившихся пиальных артерий под воздействием GB по сравнению с контрольной группой (рис. 1А). Одной из причин закрытия Катф-каналов на ранних сроках после И/Р может быть увеличение в клетках содержания АТФ, который связывается с Kir6.2 субъединицей и ингибирует канал (Дерягин и др. 2016). Уменьшение числа сузившихся на воздействие GB артерий через 7 сут. после И/Р также может быть связано со снижением плотности Катф-каналов в ГМК пиальных артерий диаметром менее 40 мкм. Косвенным доказательством этому может служить тот факт, что применение в наших экспериментах активатора Катф-каналов пинацидила (PI) через 7 сут. после И/Р головного мозга привело к расширению в 1,5 раза меньшего числа этих сосудов, чем в группе ЛО животных. У более крупных сосудов реакция на PI соответствовала таковой у ЛО крыс (рис. 2А). Итак на воздействие GB через 7 сут. после И/Р головного мозга сузилось в 2 – 5 раз меньше артерий, чем в ЛО группе, а расширилось на действие PI в 1,5 раза меньше. Вероятно, часть Катф-каналов пиальных артерий, которая не прореагировала ни на GB, ни на PI была повреждена в результате И/Р. Введение МСКч в день проведения И/Р головного мозга через 7 сут. никак не отразилось на функциональном состоянии Катф-каналов: констрикторная реакция на GB и дилататорная на PI в этой группе была такой же, как и у животных, перенесших И/Р (рис. 1А, 2А).
Через 14 сут. после И/Р головного мозга мы наблюдали увеличение числа пиальных артерий, ответивших констрикцией на воздействие GB, их было только в 1,5 – 2 раза меньше, чем у ЛО крыс (рис. 1Б). Но при этом уменьшилось число пиальных артерий, ответивших дилатацией на PI (рис. 2Б). Вероятно, поддержание адекватного уровня кровотока в этот постишемический период требует увеличения диаметра церебральных артерий, а для этого большинство Катф-каналов должно быть открыто. Отсюда и улучшение реакции на GB и ухудшение реакции на PI. В группе клеточной терапии на 14 сут. после И/Р головного мозга мы наблюдали совершенно иную картину. Число сузившихся пиальных артерий под воздействием GB и расширившихся под воздействием PI практически полностью соответствовало таковым у ЛО крыс (рис. 1Б, 2Б). Следовательно, после введения МСКч к 14 сут. после И/Р головного мозга функцинальная активность Катф-каналов пиальных артерий полностью восстановилась.
На 21 сут. после И/Р головного мозга мы наблюдали полное восстановление реакций пиальных артерий на GB до уровня ЛО крыс. Дилататорная реакция на PI была хуже (в 1,4 – 1,5 раз) по сравнению с ЛО животными только у пиальных артерии диаметром менее 40 мкм. Мы предполагаем, что через 21 сут. большинство Катф-каналов открыто. В группе клеточной терапии реактивность пиальных артерий полностью соответствовала показателям в группе ЛО животных (рис. 1В, 2В).
О вкладе Катф-каналов в AСh опосредованную дилататорную реакцию пиальных артерий после И/Р головного мозга можно судить сопоставляя степень расширения этих сосудов при воздействии чистым ACh и AСh на фоне блокировки Катф-каналов с помощью глибенкламида (ACh/GB). У ЛО животных GB блокирует дилататорную реакцию на AСh в группах сосудов всех исследованных диаметров. Следовательно Катф-каналы принимают участие в формировании дилататорного ответа на воздействие AСh.
В течение всего периода наблюдений после И/Р головного мозга расширение пиальных артерий под воздействием AСh было менее выражено, чем в группе ЛО. Применение AСh на фоне GB привело к росту числа дилатаций через 7 – 14 сут. после И/Р. В литературе имеются сведения о том, что эффективность ингибиторов Катф –каналов зависит от уровня внутриклеточных нуклеотидов, при этом особенно важную роль играет Mg-AДФ, уровень которого значительно возрастает при ишемии и гипоксии (Venkatesh et al., 1991). Поэтому существует потенциальная возможность возникновения проблем при использовании этих соединений в условиях измененного постишемического метаболического статуса и повышения уровня внутриклеточного АТФ. GB в этих условиях может, напротив, усиливать калиевый ток (Foster et al., 2016, Syed et al., 2019), что вероятно и является причиной извращения AСh опосредованных сосудистых реакций в течение первых 14 дней после И/Р.
Через 21 сут. число расширившихся сосудов на воздействие AСh и ACh/GB было одинаковым (рис. 3). Следовательно Катф-каналы практически перестают участвовать в осуществлении эндотелий-зависимой дилатации церебральных артерий после И/Р головного мозга.
Внутривенная трансплантация МСКч в день И/Р головного мозга привела во-первых к сохранению дилататорной реакции пиальных артерий на AСh: число расширившихся сосудов полностью соответствовала таковому у ЛО крыс на всех сроках наблюдения. Во-вторых, уже через 14 сут. после И/Р GB блокировал дилататорную реакцию пиальных артерий на AСh в группе клеточной терапии также, как в ЛО группе (рис. 3).
Итак, установлено, что И/Р коры головного мозга крыс снижает вклад Катф –каналов в поддержание базального тонуса пиальных артериальных сосудов. Изменения сохраняются на протяжении 14 сут. после ишемического воздействия. Одновременно с этим в период с 7 по 21 сут. после И/Р снижается роль Катф –каналов в дилатации пиальных артерий на AСh: к 21 сут. каналы практически не участвуют в дилататорном ответе. Внутривенная трансплантация МСКч в день проведения И/Р головного мозга приводит к более раннему (уже через 14 сут.) восстановлению участия Катф-каналов ГМК в поддержании базального тонуса и осуществлении AСh-опосредованной дилатации пиальных артерий.
Восстановление процессов Kатф -сигнализации и увеличение вклада АТФ чувствительных калиевых каналов в регуляции сосудистого тонуса после перенесенной И/Р может противодействовать возникновению периодических эпизодов вазоспазма и предотвращать возникновение повторных ишемических состояний, приводящих к более серьезному повреждению нейронов головного мозга.
ФИНАНСИРОВАНИЕ РАБОТЫ
Работа финансово поддержана Программой «Фундаментальные научные исследования для долгосрочного развития и обеспечения
конкурентоспособности общества и государства» (47_110_ДРиОК).
Тема 64.1 (0134-2019-0001) Раскрытие механизмов взаимодействия молекулярно-клеточных и системных регуляций функций внутренних органов.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВ
Эксперименты на крысах проводили в соответствии с регламентом, установленным МЗСР РФ № 708н от 23.08.10 («Правила лабораторной практики») и Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях, и рекомендациями биоэтической комиссии Института физиологии им. И.П. Павлова РАН.
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликта интересов.
СПИСОК ЛИТЕРАТУРЫ
Гусакова С. В., Смаглий Л. В., Бирулина Ю. Г., Ковалев И. В., Носарев А. В., Петрова И. В., Реутов В. П. 2017. Молекулярные механизмы действия газотрансмиттеров NO, CO, и H2S в гладкомышечных клетках и влияние NO-генерирующих соединений (нитратов и нитритов) на среднюю продолжительность жизни. Успехи физиологических наук. Т. 48. №1. С. 24 (Gusakova S. V., Smagliy L. V., Birulina Y. G., Kovalev I. V., Nosarev A. V., Petrova I. V., Reutov V. P. 2017. Gazotransmitters: Molecular Mechanisms of Action in Smooth Muscle Cells. Uspekhi Fiziologicheskikh Nauk. V. 48. № 1. P. 24)
ДерягинО. Г., ГавриловаС. А., БуравковС. В., АндриановВ. В., ЯфароваГ. Г., ГайнутдиновХ. Л., КошелевВ. Б. 2016. Роль АТФ-чувствительных калиевых каналов и оксида азота в защитном эффекте прекондиционирования мозга. Журнал неврологии и психиатрии им. С.С.Корсакова. Т.116. №2. С. 16. (Deryagin O.G., Gavrilova S.A., Buravkov S.V., Andrianov V.V., Yafarova G.G., Gainutdinov Kh.L., KoshelelevV. B. 2016. The role of ATP-dependent potassium channels and nitric oxide system in the neuroprotective effect of preconditioning. Zh Nevrol Psikhiatr Im S S Korsakova. V. 116. №2. P. 16.)
ДзугкоевС. Г., ДзугкоеваФ. С., МетельскаяВ. А. 2010. Роль оксида азота в формировании эндотелиальной дисфункции при сахарном диабете. Кардиоваскулярная терапия и профилактика. Т. 9. №8. С. 63. (Dzugkoev S.G., Dzugkoeva F.S., Metelskaya V.A. 2010. Nitric oxide role and endothelial dysfunction development in diabetes mellitus. Cardiovascular Therapy and Prevention. V. 9. № 8. P. 63)
Соколова И., Б., Горшкова О. П,.Павличенко Н. Н. Коррекция постишемических изменений микроциркуляции в коре головного мозга крыс с помощью мезенхимных стволовых клеток. 2021. Цитология. Т. 63. №5. С. 428. (Sokolova I. B., Gorshkova O. P., Pavlichenko N. N. 2021. Correction of post-ischemic microcirculation disturbances in the rat brain cortex by application of mesenchymal stem cells. V. 63. №5. P. 428)
Шертаев М. М., Ибрагимов У. К., Икрамова С. Х., Якубова Ф. Т., Ибрагимов К. У. Морфологические изменения в тканях головного мозга при экспериментальной ишемии. 2015. Вестник Новосибирского ГПУ. Т. 1. №23. С. 72. DOI:10.15293/2226-3365.1501.07. (Shertayev M.M., Ibragimov U. K., Ikramova S. Kh., Yakubova F. T., Ibragimov K. U. 2015. Morphological changes in brain tissues after experimental ischemia. Vestnik Novosibirskogo GPU. V. 1. №23. P. 72.)
Azizi S.A., Stokes D., Augelli B.J., DiGirolamo C., Prockop D.J. 1998. Engraftment and migration of human bone marrow stromal cells implanted in the brains of albino rats--similarities to astrocyte grafts. Proc Natl Acad Sci U S A. V.95. №7. P. 3908
Ball S., Shuttleworth C., Kielty C. 2007. Mesenchymal stem cells and neovascularization: role of platelet-derived growth factor receptors. J Cell Mol Med. V.11. №5. P. 1012
Chung T., Kim J., Choi B. 2015. Adipose-derived mesenchymal stem cells reduce neuronal death after transient global cerebral ischemia through prevention of blood-brain barrier disruption and endothelial damage. Stem Cells Trans. Med. V. 4. P. 178.
Foster M, Coetzee W. 2016. KATP Channels in the cardiovascular system. Physiol Rev. V.96. №1. P.177. https://doi.org/10.1152/ physrev. 00003
Gong Z., Niklason L. 2008. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs). FASEB J. V.22. №6. P. 1635
Liu K., Guo L., Zhou Z., Pan M., Yan C. 2019. Mesenchymal stem cells transfer mitochondria into cerebral microvasculature and promote recovery from ischemic stroke. Microvasc Res. V. 123. P. 74.
Oswald J., Boxberger S., Jorgensen B., Feldmann S., Ehninger G., Borhauser M., Werner C. 2004.Mesenchymal stem cells can be differentiated into endothelial cells in vitro. Stem Cells. V.22. P. 377
Penfornis P., Pochampally R. 2011. Isolation and expansion of mesenchymal stem cells/multipotential stromal cells from human bone marrow. Methods Mol Biol. V. 698. P. 11.
Soltani N., Mohammadi E., Allahtavakoli M., Shamsizadeh A., Roohbakhsh A., Haghparast A. 2016. Effects of dimethyl sulfoxid on neuronal response characteristics in deep layers of rat barrel cortex. Basic and clinical neurosciences. V.7. №3. P. 213. https://doi.org/10.15412/J.BCN.03070306
Sheikh A., Yano S., Mitaki S., Haque M., Yamaguchi S., Nagai A. 2019. A mesenchymal stem cells line (B10) increases angiogenesise in rat MCAO model. Exp Neurol. V. 311. P.182.
Syed A.U., Koide M., Brayden J.E., Wellman G. 2019. Tonic regulation of middle meningeal artery diameter by ATP-sensitive potassium channels. Journal of Cerebral Blood Flow and Metabolism. V.39. №4. P.670. https://doi.org/10.1177/0271678X17749392
Watt S., Gullo F., Garde M., Markeson D., Camicia R., Khoo C., Zwaginga J. 2013. The angiogenic properties of mesenchymal stem cells and their therapeutic potential. Br Med Bull. V.108. №1. P. 25.
Venkatesh N., Lamp S.T., Weiss J. 1991. Sulfonylureas, ATP-sensitive K+ channels, and cellular K+ loss during hypoxia, ischemia, and metabolic inhibition in mammalian ventricle. Circul Res. V.69. P. 623. https://doi.org/ 10.1161/01.res.69.3.623
Yang Z., Cai X., Xu A., Xu F., Liang Q. 2015. Bone marrow stromal cell transplantation through tail vein injection promotes angiogenesis and vascular endothelial growth factor expression in cerebral infarct area in rats. Cytotherapy. V.17. №9. P. 1200.
Yang H.Q., Subbotina E., Ramasamy R., Coetzee W.A. 2016. Cardiovascular KATP channels and advanced aging. Pathobiol Aging Age Relat Dis. V.6. P. 32517. doi:10.3402/pba.v6.32517
Zhou B., Tsaknakis G., Coldewell K., Khoo C., Roubelakis M., Chang C., Pepperell E., Watt S. 2012. A novel function from the haemopoietic supportive murine bone marrow MS-5 mesenchymal stromal cell line in promoting human vasculogenesis and angiogenesis. Br J Haematol. V.157. №3. P. 299.
Подписи к рисункам:
Рис. 1. Констрикторная реакция пиальных артерий под воздействием глибенкламида. а - Число сузившихся артерий через 7 сут. после ишемии/реперфузии головного мозга, б - Число сузившихся артерий через 14 сут. после ишемии/реперфузии головного мозг, в - Число сузившихся артерий через 21 сут. после ишемии/реперфузии головного мозга.
Темная заливка – ЛО крысы; светлая заливка – крысы, перенесшие ишемию; штриховка – крысы, перенесшие ишемию, которым в день операции была проведена внутривенная трансплантация МСКч. По горизонтали – диаметр пиальных артерий (мкм); по вертикали – число сузившихся артерий (%). Звездочками отмечены значимые изменения по сравнению с соответствующими значениями у ЛО животных данной группы (***р < 0.001, критерий Краскела-Уоллиса)
Рис. 2. Дилататорная реакция пиальных артерий под воздействием пинацидила.
а - Число расширившихся артерий через 7 сут. после ишемии/реперфузии головного мозга.
б - Число расширившихся артерий через 14 сут. после ишемии/реперфузии головного мозга.
в - Число расширившихся артерий через 14 сут. после ишемии/реперфузии головного мозга.
Темная заливка – ЛО крысы; светлая заливка – крысы, перенесшие ишемию; штриховка – крысы, перенесшие ишемию, которым в день операции была проведена внутривенная трансплантация МСКч. По горизонтали – диаметр пиальных артерий (мкм); по вертикали – число расширившихся артерий (%). Звездочками отмечены значимые изменения по сравнению с соответствующими значениями у ЛО животных данной группы (*р < 0.05, **р < 0.01, ***р < 0.001, критерий Краскела-Уоллиса)
Рис. 3. Дилататорная реакция пиальных артерий на воздействие ацетилхолина на фоне глибенкламида.
а - Число расширившихся артерий через 7 сут. после ишемии/реперфузии головного мозга.
б - Число расширившихся артерий через 14 сут. после ишемии/реперфузии головного мозга.
в - Число расширившихся артерий через 14 сут. после ишемии/реперфузии головного мозга.
Темная заливка – ЛО крысы; светлая заливка – крысы, перенесшие ишемию; штриховка – крысы, перенесшие ишемию, которым в день операции была проведена внутривенная трансплантация МСКч. По горизонтали – диаметр пиальных артерий (мкм); по вертикали – число сузившихся артерий (%). Звездочками отмечены значимые изменения по сравнению с соответствующими значениями у ЛО животных данной группы (***р < 0.001, критерий Краскела-Уоллиса).
Автор для ведения переписки:
Соколова Ирина Борисовна
e-mail: SokolovaIB@infran.ru
Тел. +79531550884
Служебный адрес: ул. Быкова, д. 36, с. Павлово, Всеволожский р-н, Ленинградская обл., 188680
Домашний адрес: ул. Быкова, д. 17, кв. 15, с. Павлово, Всеволожский р-н, Ленинградская обл., 188680